Inserisci almeno 3 caratteri per la tua ricerca.
Riepilogo
Excipient del solvant: Water PPI
een senza soglia di dose: Polysorbate 80 | Soglia di dose:
EEN avec dose seuil : sodio
CIP: 3400955057444 || Per 36 mesi (mantieni il riparo della luce, mantieni la confezione, non congelare)
Modalités de conservation : Avant ouverture : < 30° durant 36 mois (Conserver à l'abri de la lumière, Conserver dans son emballage, Ne pas congeler)
forme e presentazioni |
Composizione |
| di Flacon || Alfa | |
| Vonicog alfa | 650 UI* |
| o | 1300 UI* |
Solvant: Acqua per preparati iniettabili.
L'attività specifica di Veyvondi è di circa 110 interfacce di FVW: RCO/mg di proteina.
L'attività del dosaggio FVW (UI) dell'attività del cofattore di risetocetina della farmacopea europea (FVW: RCO). L'attività del cofattore di risetocetina del fattore umano von Willebrand è stata determinata rispetto al riferimento internazionale per il fattore concentrato von Willebrand (OMS).
Il Vonicog Alfa è un fattore umano ricombinante von Willebrand (FVWR). È prodotto dalla tecnica del DNA ricombinante (DNA) nelle cellule ovariche del criceto cinese (CHO) senza aggiungere proteine esogene di origine umana o animale durante le fasi della coltura cellulare, della purificazione o della formulazione finale.
Il prodotto contiene solo quantità trascurabili di fattore VIII della coagulazione ricombinante umana (≤ 0,01 FVIII/UI di FVW: RCO), determinate secondo il metodo cromogenico del dosaggio del fattore VIII (FVIII) della farmacopoeia europea.
= Excipient con un effetto noto:
Ogni bottiglia di 650 utente in polvere contiene 5,2 mg di sodio. | Contiene 10,4 mg di sodio.
Chaque flacon de 1 300 UI poudre contient 10,4 mg de sodium.
* Après reconstitution avec les 5 ml de solvant (poudre à 650 UI) ou 10 ml de solvant (poudre à 1300 UI) fournis, Veyvondi contient environ 130 UI/ml de vonicog alfa.INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Connect per accedere a questo contenuto
Contraindicazioni |
Connect per accedere a questo contenuto
caldi e precauzioni per l'uso |
in pazienti che presentano emorragia attiva, per co-somministrazione un FVIII con Veyvondi come trattamento di prima linea e secondo i tassi di FVIII ( CF Dosaggio e metodo di somministrazione).
Traceability:
Per migliorare la tracciabilità dei farmaci biologici, il nome e il numero di lotto del prodotto somministrato devono essere chiaramente registrati.
Reazioni di ipersensibilità:
sono possibili reazioni di ipersensibilità (compresa l'anafilassi). I pazienti e/o i loro caregiver devono essere informati dei primi segni di reazioni di ipersensibilità, come tachicardia, oppressione toracica, sibilanza e/o angoscia respiratoria acuta, ipotensione generalizzata, prurito, congiuntite del rinoceronte, angio edema, lighea, nausea, vomito, evocazione in shock anofilatico. In caso di shock anafilattico, è necessario introdurre un trattamento medico standard.
I pazienti devono essere attentamente monitorati per rilevare un possibile sintomo, per tutta la durata dell'infusione. Se compaiono segni e sintomi di gravi reazioni allergiche, interrompono immediatamente la somministrazione di Veyvondi e forniscono cure adeguate al paziente.
Un trattamento adeguato e attrezzature mediche devono essere immediatamente disponibili per gestire una possibile reazione anafilattica, specialmente nei pazienti con una storia di reazioni allergiche.
Veyvondi contiene quantità trascurabili di immunoglobuline G di topo (muigg) e proteine del criceto (≤ 2 ng/ui di Veyvondi). I pazienti trattati con questo farmaco possono sviluppare reazioni di ipersensibilità a queste proteine dei mammiferi non umani.
Veyvondi contiene quantità trascurabili di fattore di coagulazione ricombinante.
trombose ed embolia:
Esiste il rischio di insorgenza di eventi tromboembolici, in particolare nei pazienti con fattori di rischio clinici o organici noti per la trombosi, inclusi bassi livelli di ADAMTS13. Di conseguenza, i pazienti a rischio devono essere monitorati al fine di rilevare i primi segni di trombosi e misure profilattiche anti-trombo-emboliche devono essere stabiliti in conformità con le attuali raccomandazioni e lo standard di cura.
pazienti che richiedono frequenti dosi di Veyvondi in combinazione con il fattore VIII di ricombina FVIII: C Al fine di evitare un aumento eccessivo, probabilmente aumentare il rischio di eventi trombotici.
Tutti i FVIII somministrati con Veyvondi devono essere un prodotto contenente FVIII puro. Qualsiasi associazione con un prodotto contenente FVIII e l'FVW potrebbe costituire un ulteriore rischio di evento trombotico.
anticorps neutralizzanti (inibitori):
di anticorpi neutralizzanti (inibitori) contro il fattore von Willebrand può apparire nei pazienti con malattia di Willebrand. Se il tasso plasmatico previsto per il (FVW: RCO) non viene raggiunto o se l'emorragia non è controllata nonostante la somministrazione di una dose appropriata, è necessario effettuare analisi biologiche appropriate al fine di cercare la presenza di inibitori del fattore von Willebrand. Nei pazienti con alto livello di anticorpi neutralizzanti anti-FVW, il trattamento del fattore von Willebrand può essere inefficace e altre opzioni terapeutiche devono essere previste per garantire l'emostasi.
Il trattamento dei pazienti con MVW e con alti livelli di anticorpi (a causa del precedente trattamento da parte di FVWDP) può richiedere una dose più elevata per compensare l'effetto degli anticorpi. Questi pazienti possono essere trattati clinicamente dalla somministrazione di dosi più elevate di Vonicog Alfa, in funzione dei loro dati farmacocinetici.
Considerazioni legate agli eccipienti:
Ce médicament contient 5,2 mg de sodium par flacon de 650 UI ou 10,4 mg de sodium par flacon de 1300 UI, ce qui équivaut à 2,2 % de l'apport maximum journalier recommandé par l'OMS, soit 2 g de sodium pour un adulte de 70 kg et une dose de 80 UI/kg de poids corporel, qui doit être pris en compte pour les patients qui suivent un régime hyposodé contrôlé.
interazioni |
Connettiti per accedere a questo contenuto
Fertilità/gravidanza/allattamento |
Veyvondi non è stato oggetto di alcun studio sulle funzioni riproduttive negli animali.
Gravidanza:Esperienza nel trattamento delle donne in gravidanza o che non sono disponibili. Veyvondi dovrebbe essere somministrato alle donne in gravidanza solo se il farmaco è stato chiaramente indicato, tenendo conto del fatto che il parto conferisce un aumentato rischio di eventi emorragici in questi pazienti.
Non sappiamo se Veyvondi è escreto nel latte materno. Di conseguenza, Veyvondi dovrebbe essere somministrato alle donne con un fattore di von Willebrand che allatta solo se il farmaco è stato chiaramente indicato. Gli operatori sanitari devono tenere conto dei potenziali rischi e prescrivere Veyvondi solo se è essenziale.
Fertilità:Gli effetti di Veyvondi sulla fertilità non sono stati stabiliti.
guida e utilizzo di macchine |
Effetti avversi |
Connettiti per accedere a questo contenuto
ourdosage |
Aucun symptôme de surdosage n'a été rapporté avec le facteur von Willebrand. Des événements thrombo-emboliques peuvent survenir en cas de surdosage important.
Farmacodinamica |
Connettiti per accedere a questo contenuto
Farmacocinetica |
Connettiti per accedere a questo contenuto
SÉCURITÉ PRÉCLINIQUE |
I dati non clinici derivanti da studi convenzionali sulla farmacologia della sicurezza, la tossicologia in somministrazione ripetuta, genotossicità, cancerogenesi e funzioni riproduttive e di sviluppo, non hanno rivelato alcun rischio particolare per l'uomo.
Non sono state condotte indagini riguardanti la cancerogenicità, i disturbi della fertilità e lo sviluppo fetale. In un modello di infusione di placenta ex vivo humain, Veyvondi n'a pas traversé la barrière placentaire humaine.
incompatibilità |
Questo farmaco non deve essere miscelato con altri farmaci ad eccezione di quelli menzionati nella sezione || EliminazioneModalités de manipulation et d'élimination.
Metodi di riforma |
da mantenere a una temperatura non superiore a 30 ° C, nella confezione originale, riparata dalla luce. Non congelare.
Metodi di modellazione/eliminazione |
Istruzioni generali:
Istruzioni per la ricostruzione e l'amministrazione
 |
1) Rimuovere i tappi da veyvondi e bottiglie di polvere di solvente per esporre il centro dei tappi di gomma.
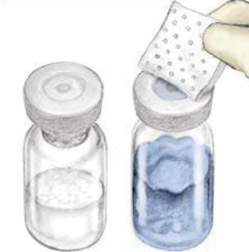 |
2) Disinfetta gli ingorghi portarli con un distinto timbro alcolico sterile (o qualsiasi altra soluzione sterile adattata all'emofilia) per diversi secondi. Lasciare asciugare gli ingorghi prima dell'uso. Posizionare le bottiglie su una superficie piana.
3) Apri la confezione del dispositivo mix2vial, rimuovendo completamente la perfezione senza toccare l'interno della confezione. Non rimuovere il dispositivo mix2vial dalla confezione.
 |
4) girare la confezione con il dispositivo mix2vial e posizionarlo sopra la bottiglia di solvente. Metti il perforatore di plastica blu nel dispositivo saldamente e dritto al centro del tappo della bottiglia di solvente. Rimuovere l'imballaggio dal dispositivo Mix2vial tenendola per i bordi. Assicurati di non toccare il perforatore di plastica trasparente. La bottiglia di solvente è ora collegata al dispositivo mix2vial ed è pronta per essere collegata alla bottiglia Veyvondi.
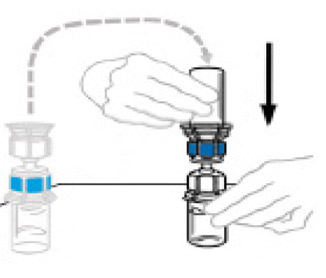 |
5) per collegare la bottiglia di solvente alla bottiglia Veyvondi, girare la bottiglia di solvente e posizionarla sopra la bottiglia contenente la polvere Veyvondi. Completamente e dritto il perforatore di plastica trasparente nella bottiglia di polvere Vyvondi. Questo dovrebbe essere eseguito immediatamente per evitare la contaminazione del liquido dai germi. Il solvente scorre nella bottiglia di polvere Veyvondi sotto l'effetto del vuoto. Verificare che l'intero solvente sia stato trasferito. Non utilizzare se la bottiglia non è più sotto vuoto e se il solvente non scorre nella bottiglia Venyvondi.
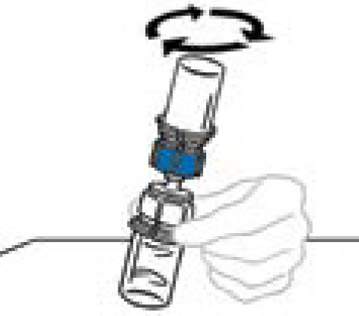 |
6) Agitare delicatamente e costantemente le bottiglie collegate o lasciare riposare il prodotto ricostituito per 5 minuti e quindi succhiarlo delicatamente per dissolvere completamente la polvere. Non agitare, modificherebbe il prodotto. Non mettere la soluzione in frigorifero dopo la ricostruzione.
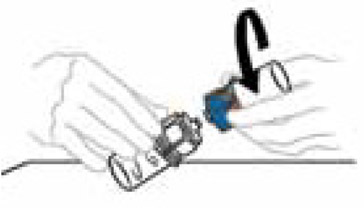 |
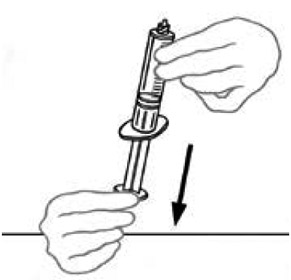
7) Disolicizzare le due parti del dispositivo mix2viale l'altra tenendo la parte di plastica trasparente collegata alla bottiglia Veyvondi con una mano e la parte di plastica blu del dispositivo mix2viale collegato alla bottiglia di solvente dell'altra mano. Separare le due bottiglie svitando la parte di plastica blu nella direzione opposta degli aghi di un orologio. Non toccare l'estremità del raccordo di plastica collegato alla bottiglia Veyvondi contenente il prodotto disciolto. Posizionare la bottiglia Veyvondi su una superficie di lavoro piatta. Lancia la bottiglia di solvente vuota.
 |
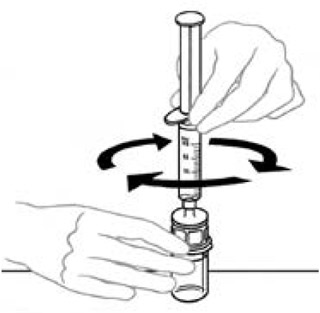
8) Aspire aria nella siringa di plastica sterile per un uso vuoto tirando il pistone. La quantità di aria deve essere uguale alla quantità di veyvondi ricostituita che verrà rimossa dalla bottiglia.
 |
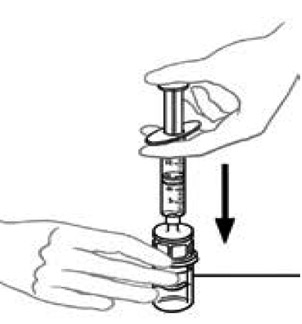
9) Lasciando la bottiglia Veyvondi (contenente il prodotto ricostituito) posizionata sulla superficie di lavoro piatta, collegare la siringa al raccordo trasparente in plastica e avvitare la siringa nella direzione degli aghi di un orologio. | Con una mano e l'altra mano, iniettare la quantità totale di aria della siringa nella bottiglia.
 |
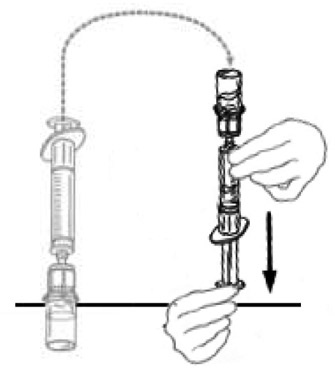
10) Tenir le flacon d'une main et de l'autre main, injecter la quantité totale d'air de la seringue dans le flacon.
 |
11) Restituisci la siringa collegata alla bottiglia Veyvondi in modo che la bottiglia sia sopra la siringa. Mantieni il pistone all'interno della siringa, premendolo. Prendi Veyvondi nella siringa tirando lentamente il pistone.
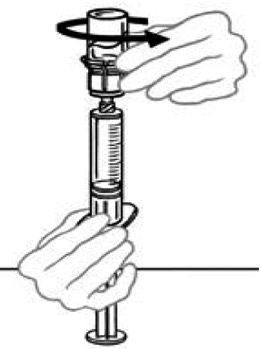 |
12) La soluzione non deve essere presa dalla bottiglia nella siringa e quindi reinventata nella bottiglia, questo potrebbe danneggiare il farmaco. Una volta pronto per l'infusione, scollegare la siringa svitando la direzione opposta degli aghi di un orologio. Ispezionare visivamente la siringa per garantire l'assenza di particelle; La soluzione deve essere chiara e incolore. Se nella soluzione si osservano scaglie o particelle, non usarlo e avvertire il medico.
13) in caso di più di una bottiglia Veyvondi per ricostruire la dose:14) Il contenuto di due bottiglie può essere preso da una singola siringa.
Nota: lors de l'injection d'air dans un deuxième flacon de Veyvondi devant être transféré dans une seringue, positionner le flacon et la seringue connectée de telle sorte que le flacon soit au-dessus.
Instructions d'administration :
Ispezionare la soluzione preparata nella siringa per verificare l'assenza di particelle e l'alterazione del colore prima della somministrazione (la soluzione deve essere chiara, incolore ed esente dalle particelle). Non è raro che alcuni fiocchi di sospensione o particelle rimangano nel bottiglia di prodotto dopo la ricostituzione. Il filtro incluso nel dispositivo mix2viale elimina completamente queste particelle. La filtrazione non influenza i calcoli della dose da somministrare. La soluzione presente nella siringa non deve essere usato se è turbato o contiene fiocchi o particelle dopo la filtrazione.
== Volumi di Veyvondi sono necessari, è possibile raggruppare due bottiglie di Veyvondi. Il contenuto di ciascun prodotto ricostituito di Veyvondi può essere preso da una singola siringa. Tuttavia, in questi casi, la soluzione inizialmente ricostituita di Veyvondi non deve essere diluita.
amministrare avanzato la soluzione per via endovenosa ( DOSAGGIO CF e modalità di somministrazione), senza superare un flusso di 4 ml/min. | Posizionare l'ago, la siringa e Veyvondi e le bottiglie vuote in un collettore di oggetti affilati rigidi in modo che vengano eliminati in modo appropriato. Non gettare questi materiali in una normale spazzatura dei rifiuti domestici.
Ne pas replacer le capuchon sur l'aiguille. Placer l'aiguille, la seringue et les flacons de Veyvondi et de solvant vides dans un collecteur d'objets tranchants rigide pour qu'ils soient éliminés de manière appropriée. Ne pas jeter ces matériaux dans une poubelle d'ordures ménagères ordinaire.
Qualsiasi farmaco non utilizzato o i rifiuti devono essere eliminati in conformità con i regolamenti in vigore.
prescrizione/consegna/supporto |
| = Hospitalle. | |
| AMM | EU/1/18/1298/001; CIP 3400955057437 (15.11.2023) FL 650 UI. |
| EU/1/18/1298/002; CIP 3400955057444 (15.11.2023) FL 1300 UI. | |
| raccolta. |
| order Cale and Responsabilità (HT) di UCD: | |
| UCD 3400894403210 (FL 650 UI): 611.171 Euro. | |
| UCD 3400894403159 (FL 1300 UI): 1222.341 euro. | |
| registrato nell'elenco delle retrocession con supporto al 100% e nell'elenco delle specialità supportate oltre a GHS. | The AMM: | |
Titulaire de l'AMM : Baxalta Innovations GmbH, Industri è 67, 1221 Vienne, Austria.