Inserisci almeno 3 caratteri per la tua ricerca.
Riepilogo
= Excipient del solvente:= Water PPI
CIP: 3400930023877
Metodi di lettura: Prima di aprire: 2 ° <8 ° Durant 36 mesi (Keep in the Shelter of Light, Keep In Your Packaging, Keep in Frigrator, NON Freeze)
forme e presentazioni |
Somavert 10 mg in polvere e solvente per soluzione iniettabile
polvere (da bianco a leggermente bianco) iniettabile.
Vial contenente 10 mg di polvere (vetro di pietra i) dotato di una spina (gomma clorobutil) +siringa pre-riempita da 1 ml (acqua per preparazioni di iniezione) (vetro borosilicato di tipo I) dotato di una spina a pistone (gomma bromobutyle) e (gomma bromobutyle).
Il colore del tappo di protezione in plastica è specifico per il dosaggio del prodotto.
scatola di 30 bottiglie, siringhe pre -riempite e aghi di sicurezza.
Somavert 15 mg in polvere e solvente per soluzione di iniezione
polvere (da bianco a leggermente bianco) e solvente iniettabile.
Vial contenente 15 mg di polvere (vetro di tipo Flint di tipo I) dotato di una spina (gomma clorobutilico) +siringa pre-riempita da 1 ml (acqua per preparati di iniezione) (vetro borosilicato di tipo I) dotato di una spina a pistone (gomma bromobutilico) e (gomma bromobutyle).
Il colore del tappo di protezione in plastica è specifico per il dosaggio del prodotto.
Box di 30 bottiglie, siringhe pre -riempite e aghi di sicurezza.
Somavert 20 mg in polvere e solvente per soluzione iniettabile
polvere (da bianco a leggermente bianco) e solvente iniettabile.
Vial contenente 20 mg di polvere (vetro di tipo Flint di tipo I) dotato di una spina (gomma clorobutilico) +siringa pre-riempita da 1 ml (acqua per preparazioni di iniezione) (vetro borosilicato di tipo I) con tappo a pistone (gomma bromobutile) e (gomma bromobutili).
Il colore del tappo di protezione in plastica è specifico per il dosaggio del prodotto.
Box di 1 o 30 bottiglia (S), siringa (S) e ago predefinite. Soluzione iniettabile.
SOMAVERT 25 mg poudre et solvant pour solution injectable
Poudre (blanche à légèrement blanche) et solvant pour solution injectable.
Fial contenente 25 mg di polvere (vetro di foca di tipo I) dotato di una spina (gomma clorobutile) +solvente da 1 ml pre-riempito (acqua per preparati di iniezione) (vetro borosilicato di tipo I) con tappo a pistone (gomma bromobutile) e (gomma bromobutili).
Il colore del tappo di protezione in plastica è specifico per il dosaggio del prodotto.
scatola di 30 bottiglie, siringhe pre -riempite e aghi di sicurezza.
Somavert 30 mg in polvere e solvente per soluzione di iniezione
polvere (da bianco a leggermente bianco) e solvente iniettabile.
Fial contenente 30 mg di polvere (vetro di tipo Flint di tipo I) dotato di una spina (gomma clorobutilico) +siringa con solvente da 1 ml pre-riempita (acqua per preparazioni iniettabili) (vetro borosilicato di tipo I) dotato di un cappello da pistone (gomma bromobutile) e (gomma bromobutile).
Il colore del tappo di protezione in plastica è specifico per il dosaggio del prodotto.
scatola di 30 bottiglie, siringhe pre -riempite e aghi di sicurezza.
Composizione |
Somavert 10 mg in polvere e solvente per soluzione di iniezione
Una bottiglia contiene 10 mg di pegvisomant.
Dopo la ricostituzione, 1 ml di soluzione contiene 10 mg di pegvismant.*
= Excipient con un effetto noto:
Il farmaco dosato a 10 mg contiene 0,4 mg di bottiglia di sodio per polvere. | 15 mg di polvere e solvente per soluzione iniettabile
SOMAVERT 15 mg poudre et solvant pour solution injectable
Una bottiglia contiene 15 mg di pegvismant.
Dopo la ricostituzione, 1 ml di soluzione contiene 15 mg di pegvismant.*
= Effetto noto:
Il farmaco dosato a 15 mg contiene 0,4 mg di polvere di sodio.
Somavert 20 mg in polvere e solvente per soluzione di iniezione
Una bottiglia contiene 20 mg di pegvisamant.
Dopo la ricostituzione, 1 ml di soluzione contiene 20 mg di pegvisamant.*
Excipient con notorio effetto: | Contiene 0,4 mg di sodio per fiala di polvere.
Le médicament dosé à 20 mg contient 0,4 mg de sodium par flacon de poudre.
Somavert 25 mg in polvere e solvente per soluzione di iniezione
Una bottiglia contiene 25 mg di pegvismant.
Dopo la ricostituzione, 1 ml di soluzione contiene 25 mg di pegvisomant.*|| Notorious:
Excipient à effet notoire :
Il farmaco dosato a 25 mg contiene 0,5 mg di sodio per bottiglia in polvere.
Somavert 30 mg in polvere e solvente per soluzione di iniezione
Una bottiglia contiene 30 mg di pegvismant.
Dopo la ricostituzione, 1 ml di soluzione contiene 30 mg di pegvisomant.*
Excipient con notorio effetto:
Il farmaco dosato a 30 mg contiene 0,6 mg di bottiglia di sodio per polvere.
* Prodotto in celle di Escherichia coli par la technique de l'ADN recombinant.
polvere: glicina, mannitolo (E421), fosfato disodio anidro, sodio diidrogenofosfato monoidrato.
Solvant: eau pour préparations injectables.
Indicazioni |
Trattamento acromomeale in pazienti adulti che hanno avuto una risposta insufficiente alla chirurgia e/o alla radioterapia e in cui un trattamento medico appropriato dagli analoghi della somatostatina non ha concentrazioni standardizzate in IGF-I o non è stato tollerato. | Amministrazione
POSOLOGIE ET MODE D'ADMINISTRATION |
Connect per accedere a questo contenuto
Contraindicazioni |
Connect per accedere a questo contenuto
gufi e precauzioni per l'uso |
Traceability | I farmaci biologici, il nome e il numero del lotto del prodotto somministrato devono essere chiaramente registrati.
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
tumori che secernono l'ormone della crescita
Étant donné que les tumeurs pituitaires sécrétant de l'hormone de croissance peuvent parfois se développer et engendrer des complications graves (p. ex., altération du champ visuel) : il est primordial de surveiller attentivement tous les patients. Si des signes d'expansion tumorale apparaissent, des alternatives thérapeutiques peuvent être envisagées.
Sorveglianza delle concentrazioni sieriche di IGF-1
Il pegvismant è un potente antagonista dell'ormone della crescita. La somministrazione di questo farmaco può causare una tabella del deficit dell'ormone della crescita, nonostante la presenza di alti tassi di crescita dell'ormone sierico. Le concentrazioni del siero IGF-1 devono essere monitorate e mantenute nell'intervallo normale corrispondente all'età del paziente adattando la dose di PEGVisomant.
Aumentazioni delle concentrazioni di ALAT o ASAT
Avant de débuter le traitement par SOMAVERT, les patients doivent faire l'objet d'une évaluation des tests de la fonction hépatique (TFH) initiaux [alanine aminotransférase (ALAT) sérique, aspartate aminotransférase (ASAT), bilirubine sérique totale (BILT) et phosphatase alcaline (PAL)].
Il faudra éliminer une pathologie obstructive des voies biliaires en cas d'augmentation des concentrations d'ALAT et d'ASAT ou en cas d'antécédents de traitement par tout analogue de la somatostatine. L'administration du pegvisomant devra être arrêtée si les signes ou symptômes de dysfonctionnement hépatique persistent.
Pour des recommandations relatives à l'instauration de SOMAVERT en fonction des tests de la fonction hépatique (TFH) initiaux et des recommandations relatives à la surveillance des tests de la fonction hépatique pendant le traitement par SOMAVERT, se reporter au tableau A.
| TFH Iniziali |
Raccomandazioni |
| Normale |
|
| allevato, ma inferiore o uguale a 3 volte l'LSN |
|
| = maggiore di 3 volte l'LSN |
|
Abbreviazioni: alat = alanina aminotransferasi; Asat = aspartato aminotransferasi; TFH = test della funzione epatica; LSN: limite superiore al normale.
Se un paziente ha aumenti di TFH o qualsiasi altro segno o sintomo della disfunzione epatica durante il trattamento con Somavert, si raccomanda la seguente gestione (Tabella B).
| TFH e segni/sintomi clinici |
Raccomandazioni |
| elévés, ma meno o uguale a 3 volte l'LSN |
|
| maggiore di 3 ma meno di 5 volte l'LSN (senza segni/sintomi di epatite o altra lesione epatica, o aumento dell'angolo sierico) |
|
| == 5 volte l'LSN o elevazioni delle transaminasi di almeno 3 volte l'LSN associato ad un aumento del siero di gamma (con o senza segni/sintomi di epatite o altre lesioni epatiche) |
|
| segni o sintomi evocativi di epatite o altra lesione epatica (ad esempio, ittero, bilirubinuria, affaticamento, nausea, vomito nel quadrante in alto a destra, ascite, edema inspiegabile, fragilità cutanea con trauma) |
|
Ipoglicemia
L'étude conduite avec le pegvisomant chez les patients diabétiques traités par insuline ou par hypoglycémiants oraux a révélé un risque d'hypoglycémie dans cette population. En conséquence, chez les patients acromégales et diabétiques, une réduction des doses d'insuline ou d'hypoglycémiants oraux pourra être nécessaire (voir rubrique Interazioni).
= Miglioramento della fertilità
Benefici terapeutici di una riduzione della concentrazione di IGF-1 Un miglioramento della condizione clinica dei pazienti, potrebbe anche migliorare la fertilità dei pazienti (vedere Sezione Fertilità/gravidanza/allattamento).
gravidanza
Il controllo dell'acromegalia può migliorare durante la gravidanza. Il PEGVisOMant non è raccomandato durante la gravidanza (vedere la sezione Fertilità/gravidanza/allattamento al seno). Se durante la gravidanza viene utilizzato il PEGVisomant, i livelli di IGF-I devono essere attentamente monitorati e potrebbe essere necessario regolare le dosi di PEGVisomant (vedere Sezione Dosaggio e modalità di amministrazione) in funzione dei valori di IGF-I. | Meno di 1 mmol di sodio (23 mg) per dose. I pazienti che seguono una dieta iposofila possono essere informati che questo farmaco è "essenzialmente senza sodio".
Teneur en sodium
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose. Les patients suivant un régime hyposodé peuvent être informés que ce médicament est « essentiellement sans sodium ».
interazioni |
Connect per accedere a questo contenuto
Fertilità/Gravidanza/Affetto al seno |
gravidanza
PEGVISOMANT nelle donne in gravidanza. Gli studi condotti negli animali non sono sufficienti per consentirci di concludere sulla tossicità sulla riproduzione (vedere la sezione Sicurezza preclinica).
Somavert non è raccomandato durante la gravidanza e nelle donne in età di procreazione che non utilizzano la contraccezione. | La gravidanza, le tariffe IGF-I dovrebbero essere attentamente monitorate, specialmente durante il primo trimestre. Potrebbe essere necessario regolare la dose di pegvisomant durante la gravidanza (vedere la sezione
Si le pegvisomant est utilisé pendant la grossesse, les taux d'IGF-I doivent être étroitement surveillés, en particulier pendant le premier trimestre. Il peut être nécessaire d'ajuster la dose de pegvisomant pendant la grossesse (voir rubrique Avvertenze e precauzioni per l'uso).
allattamento al seno
L'escrezione del pegvisomante nel latte materno non è stata studiata negli animali. I dati clinici sono troppo limitati (un caso riportato) per concludere che l'escrezione di PEGVisomant nel latte materno umano. Pertanto, il pegvisomante non dovrebbe essere usato nelle donne che allattano. Tuttavia, l'allattamento al seno può essere continuato se questo farmaco viene interrotto: questa decisione deve tener conto del beneficio del trattamento da parte di PEGVISOMANT per la madre e del beneficio dell'allattamento al seno per il bambino.
Fertilità
Nessun dato sulla fertilità è disponibile per PEGVisamant. | Portando a un miglioramento delle condizioni cliniche dei pazienti, potrebbe anche migliorare la fertilità dei pazienti.
Les bénéfices thérapeutiques d'une réduction de la concentration d'IGF-1, conduisant à une amélioration de l'état clinique des patients, pourraient également améliorer la fertilité des patientes.
guida e utilizzo di macchine |
Gli effetti sulla capacità di guidare i veicoli e di usare le macchine non sono stati studiati.
= Effetti indesiderati |
Connect || Contenuto pour accéder à ce contenu
Overdosage |
L'esperienza di un sovradosaggio con il pegvisomante è limitata. È stato segnalato un singolo caso di sovradosaggio acuto per il quale un paziente, avendo ricevuto 80 mg/die per 7 giorni, ha presentato una leggera affaticamento e siccità aggiuntive dalla bocca. Nella settimana successiva al trattamento, sono stati notati i seguenti effetti collaterali: insonnia, affaticamento aggiuntivo, edema periferico, tremori e aumento di peso. Due settimane dopo l'interruzione del trattamento, sono state osservate la leucocitosi e l'emorragia moderata a livello di iniezione o siti di puntura venosa, che possono essere considerati attribuibili al PEGVISOMANT.
In caso di sovradosaggio, la somministrazione di questo farmaco deve essere interrotta e non deve essere ripresa prima che i tassi di IGF-1 vengano restituiti all'intervallo normale o al di sopra di questo.
Farmacodinamica |
Connettiti per accedere a questo contenuto
Pharmacokinetics |
Connect per accedere a questo contenuto
= Sicurezza preclinica |
tossicologia nella somministrazione ripetuta nei ratti e nelle scimmie non hanno rivelato alcun rischio particolare per l'uomo. Tuttavia, a causa della marcata risposta farmacologica nella scimmia, non sono state studiate esposizioni sistemiche superiori a quelle colpite nei pazienti trattati a dosi terapeutiche.
Nello studio di carcinogenesi nei ratti, istiocitomi fibrosi intelligenti, associati alla fibrosi e all'infiammazione istiocitica, sono stati osservati in siti di iniezione nei maschi e questo a livelli di esposizione tre volte superiore all'esposizione negli esseri umani sulla base delle concentrazioni plasmatiche ottenute durante due studi a lungo termine a un dose giornaliera di 30 mg. La rilevanza clinica di questa osservazione per l'uomo non è nota. L'aumentata incidenza dei tumori nel sito di iniezione è stata probabilmente causata dall'irritazione e dalla grande sensibilità del ratto alle iniezioni sottocutanee ripetute.
Studi sullo sviluppo embrionale precoce e lo sviluppo dell'embrione-fetica sono stati condotti in conigli incinti con pegvisomant in dosi sottocutanee di 1, 3 e 10 mg/kg/giorno. Non vi sono state prove di effetti teratogeni associati alla somministrazione del PEGVisomant durante l'organogenesi. Ad una dose di 10 mg/kg/die (6 volte la massima dose terapeutica nell'uomo in funzione della superficie corporea), in entrambi gli studi è stato osservato un aumento delle perdite post-setting. Non sono stati condotti studi sulla fertilità.
incompatibilità |
In assenza di studi di compatibilità, questo farmaco non deve essere miscelato con altri farmaci.
Conservazione degli ufficiali |
3 anni.
Dopo la ricostituzione, il prodotto deve essere utilizzato immediatamente. | Conservazione specifica
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
Mantieni le bottiglie di polvere in frigorifero (tra 2 ° C e 8 ° C). Non congelare. Mantieni le bottiglie nel loro imballaggio al riparo dalla luce.
L'imballaggio contenente le bottiglie di polvere Somavert può essere mantenuta a temperatura ambiente fino a un massimo di 25 ° C per un singolo periodo di 30 giorni al massimo. La scadenza per l'uso deve essere registrata sulla confezione (fino a 30 giorni dalla data di rilascio del frigorifero). Le bottiglie devono essere tenute lontano dalla luce e non devono essere somministrate in frigorifero. Le bottiglie di polvere Somavert devono essere lanciate se non vengono utilizzate entro 30 giorni dalla conservazione a temperatura ambiente o alla data di scadenza stampata sulla confezione, secondo il primo verificarsi.
Mantenere le siringhe pre -riempite a una temperatura non superiore a 30 ° C o in frigorifero (tra 2 ° C e 8 ° C). Non congelare.
Dopo la ricostruzione:
Per le condizioni di conservazione del farmaco dopo la ricostruzione, vedere la sezione Durata della conservazione.
= Precauzioni particolari per l'eliminazione e la manipolazione |
La siringa e l'ago di sicurezza utilizzato sono forniti con il farmaco.
Rimuovere il cappuccio dalla siringa pre -riempita prima di montare l'ago di sicurezza fornito rompendo il cappuccio. La siringa deve essere mantenuta in una posizione verticale per evitare un flusso. Evita il contatto con la fine della siringa con qualsiasi cosa.

La polvere deve essere ricostruita con 1 ml di solvente. Per l'aggiunta del solvente a siringa, tenere la bottiglia inclinata e la siringa come illustrato nella figura seguente.
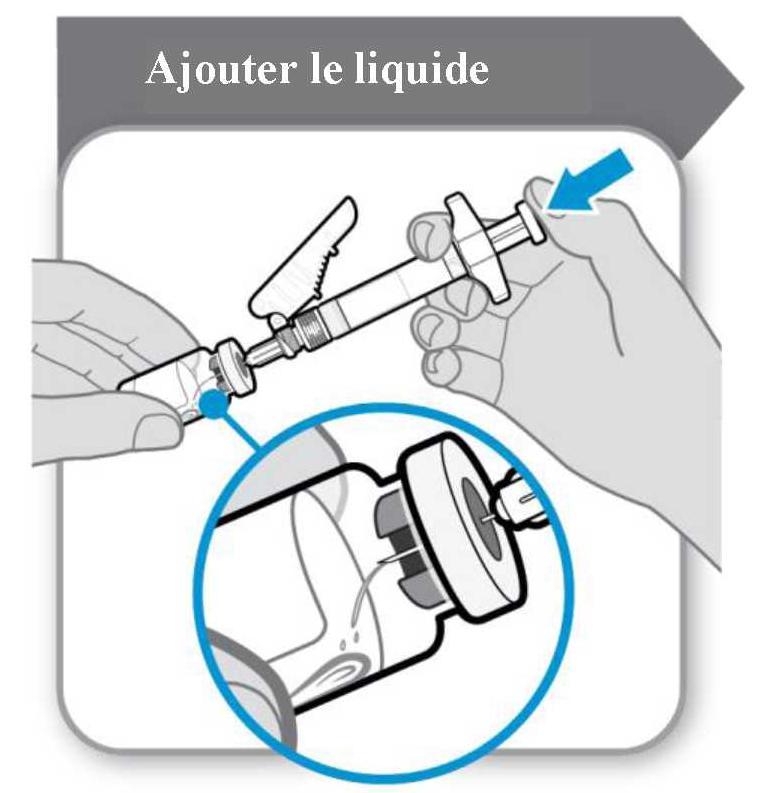
Aggiungi il solvente alla bottiglia in polvere. Il solvente deve essere trasferito lentamente alla bottiglia per evitare il rischio di formazione di schiuma. Ciò renderebbe il farmaco inutilizzabile. Sciogliere delicatamente la polvere con un movimento a rotazione lenta. Non agitare vigorosamente perché potrebbe distorcere la sostanza attiva.
Après reconstitution, la solution reconstituée doit être inspectée visuellement pour s'assurer de l'absence de particules externes (ou étrangères) et d'anomalies quelconques de l'aspect physique avant l'administration. Si ce n'est pas le cas, le médicament doit être détruit.
= Rimuovere l'ago verso il basso in modo che la fine dell'ago nel liquido. Indietro lentamente lungo il pistone della siringa per prendere il farmaco dalla bottiglia. In caso di presenza aerea nella siringa, tocca il cilindro della siringa per far apparire le bolle, quindi espellere delicatamente le bolle nella bottiglia.

Reculer l'aiguille vers le bas de manière à ce que l'extrémité de l'aiguille soit positionnée au point le plus bas dans le liquide. Reculer lentement le piston de la seringue pour prélever le médicament du flacon. En cas de présence d'air dans la seringue, tapoter le cylindre de la seringue pour faire remonter les bulles, puis expulser délicatement les bulles dans le flacon.
Prima di eliminare la siringa e l'ago, piegare la protezione dell'ago sull'ago e assicurarsi che sia adeguatamente bloccato (sentiamo un clic). Non riutilizzare mai la siringa e l'ago.
per uso singolo. Eventuali farmaci inutilizzati o di scarto devono essere eliminati in conformità con i regolamenti in vigore.
prescrizione/consegna/supporto |
| AMM |
|
| Prezzo: |
|
| AMM |
|
| Prezzo: |
|
| AMM |
|
| Prezzo: |
|
| AMM |
|
| Prezzo: |
|
Resta SEC SoC al 100 %. Raccogliere.
| AMM |
|
| Prezzo: |
|