Inserisci almeno 3 caratteri per la tua ricerca.
Riepilogo
= Excipient del solvente:= Water PPI
CIP: 3400936118102
Metodi di riforma: prima di aprire: <25 ° per 30 giorni (mantieni il riparo della luce, da usare una volta il frigorifero), 2 °
CIP: 3400936225060
= Luce, da usare una volta il frigorifero), 2 °
forme e presentazioni |
Somavert 10 mg in polvere e solvente per soluzione iniettabile
polvere (da bianco a leggermente bianco) e solvente per soluzione iniettabile. | (gomma clorobutilico) +1 ml pre-riempita di solvente (acqua per preparazioni di iniezione) (vetro borosilicato I) dotato di un cappuccio a pistone (gomma bromobutilico) e da an-to-cout (gomma bromobutilico).
Flacon contenant 10 mg de poudre (verre flint de type I) muni d'un bouchon (caoutchouc chlorobutyl) + seringue préremplie de 1 ml de solvant (eau pour préparations injectables) (verre borosilicate de type I) munie d'un bouchon piston (caoutchouc bromobutyle) et d'un protège-embout (caoutchouc bromobutyle).
Il colore del tappo di protezione in plastica è specifico per il dosaggio del prodotto.
Box di 30 bottiglie, siringhe pre -riempite e aghi di sicurezza.
Somavert 15 mg in polvere e solvente per soluzione iniettabile
polvere (da bianco a leggermente bianco) e solvente per soluzione iniettabile.
Vial contenente 15 mg di polvere (vetro di tipo Flint di tipo I) dotato di una spina (gomma di clorobutil) +siringa pre-riempita da 1 ml (acqua per preparazioni di iniezione) (vetro borosilicato di tipo I) dotato di una spina a pistone (gomma bromobutilica) e (gomma bromobutyle).
Il colore del tappo di protezione in plastica è specifico per il dosaggio del prodotto.
scatola di 30 bottiglie, siringhe preiedate e aghi di sicurezza.
Somavert 20 mg in polvere e solvente per soluzione di iniezione
polvere (da bianco a leggermente bianco) e solvente iniettabile.
Fial contenente 20 mg di polvere (vetro di tipo Flint di tipo I) dotato di una spina (gomma di clorobutil) +siringa pre-riempita da 1 ml (acqua per preparazioni di iniezione) (vetro borosilicato di tipo I) dotato di una spina a pistone (gomma bromobutilico) e (gomma bromobutyle).
Il colore del tappo di protezione in plastica è specifico per il dosaggio del prodotto.
Box di 1 o 30 bottiglia (S), siringa (S) pre -riempita e ago di sicurezza.
Somavert 25 mg in polvere e solvente per soluzione iniettabile
polvere (bianco con leggermente bianco) e solvente per soluzione iniettabile. | Tipo I) dotato di un cappuccio (gomma clorobutil) +siringa 1 ml pre-riempita (acqua per preparazioni iniettabili) (vetro borosilicato I) dotato di una spina a pistone (gomma bromobutilica) e una protezione a spazzola (gomma bromobutyle).
Flacon contenant 25 mg de poudre (verre flint de type I) muni d'un bouchon (caoutchouc chlorobutyl) + seringue préremplie de 1 ml de solvant (eau pour préparations injectables) (verre borosilicate de type I) munie d'un bouchon piston (caoutchouc bromobutyle) et d'un protège-embout (caoutchouc bromobutyle).
Il colore del tappo di protezione in plastica è specifico per il dosaggio del prodotto.
Box di 30 bottiglie, siringhe pre -riempite e aghi di sicurezza.
Somavert 30 mg in polvere e solvente per soluzione di iniezione
polvere (da bianco a leggermente bianco) e solvente iniettabile.
Vial contenente 30 mg di polvere (vetro di tipo Flint di tipo I) dotato di una spina (gomma di clorobutil) +siringa con solvente da 1 ml pre-riempita (acqua per preparazioni iniettabili) (vetro borosilicato di tipo I) dotato di un cappello da pistone (gomma bromobutilico) e (gomma bromobutile).
Il colore del tappo di protezione in plastica è specifico per il dosaggio del prodotto.
scatola di 30 bottiglie, siringhe pre -riempite e aghi di sicurezza.
Composizione |
Somavert 10 mg in polvere e solvente per soluzione di iniezione
Una bottiglia contiene 10 mg di pegvisomant.
Dopo la ricostituzione, 1 ml di soluzione contiene 10 mg di pegvisamant.*
Excipient con un effetto noto:
Il farmaco dosato a 10 mg contiene 0,4 mg di bottiglia di sodio per polvere. Iniettabile
SOMAVERT 15 mg poudre et solvant pour solution injectable
Una bottiglia contiene 15 mg di pegvisomant.
Dopo la ricostituzione, 1 ml di soluzione contiene 15 mg di pegvisomant.*
= Excipient con un effetto noto:
Il farmaco drogato a 15 mg contiene 0,4 mg di sodio per bottiglia di polvere.
Somavert 20 mg in polvere e solvente per soluzione iniettabile
Un flacon contient 20 mg de pegvisomant.
Dopo la ricostituzione, 1 ml di soluzione contiene 20 mg di pegvisamant.*
= Effetto noto: || Contiene 0,4 mg di sodio per bottiglia di polvere.
Le médicament dosé à 20 mg contient 0,4 mg de sodium par flacon de poudre.
Somavert 25 mg in polvere e solvente per soluzione di iniezione
Una bottiglia contiene 25 mg di pegvisamant.
Dopo la ricostituzione, 1 ml di soluzione contiene 25 mg di pegvisomant.*
Excipient à effet notoire :
Il farmaco dosato a 25 mg contiene 0,5 mg di sodio per bottiglia di polvere.
Somavert 30 mg di polvere e solvente per soluzione di iniezione
Una bottiglia contiene 30 mg di pegvisamant.
Dopo la ricostituzione, 1 ml di soluzione contiene 30 mg di pegvisomant. *|| 743
Excipient à effet notoire :
Il farmaco dosato a 30 mg contiene 0,6 mg di bottiglia di sodio per polvere.
* Prodotto in celle di Escherichia coli ricombinante.
polvere: glicina, mannitolo (E421), disodio anidro fosfato, diidrogenofosfato di sodio monoidrato.
Solvant: || 760 == iniettabile. eau pour préparations injectables.
Indicazioni |
Trattamento dell'acromegalia nei pazienti adulti che hanno avuto una risposta insufficiente alla chirurgia e/o alla radioterapia e in cui un trattamento medico appropriato dagli analoghi della somatostatina non ha concentrazioni standardizzate in IGF-I o non è stato tollerato. | Amministrazione
POSOLOGIE ET MODE D'ADMINISTRATION |
Connect per accedere a questo contenuto
Contraindicazioni |
Connect per accedere a questo contenuto
= caldi e precauzioni per l'uso |
Traceability || Biologico, il nome e il numero batch del prodotto somministrato devono essere chiaramente registrati.
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
tumori che secernono l'ormone della crescita
Étant donné que les tumeurs pituitaires sécrétant de l'hormone de croissance peuvent parfois se développer et engendrer des complications graves (p. ex., altération du champ visuel) : il est primordial de surveiller attentivement tous les patients. Si des signes d'expansion tumorale apparaissent, des alternatives thérapeutiques peuvent être envisagées.
Concentrazioni sieriche di monitoraggio IGF-1
Il pegvismant è un potente antagonista dell'ormone della crescita. La somministrazione di questo farmaco può causare una tabella del deficit dell'ormone della crescita, nonostante la presenza di alti tassi di crescita dell'ormone sierico. Le concentrazioni di sieri IGF-1 devono essere monitorate e mantenute nell'intervallo normale corrispondente all'età del paziente adattando la dose di PEGVisomant.
Aumentazioni delle concentrazioni di ALAT o ASAT
Avant de débuter le traitement par SOMAVERT, les patients doivent faire l'objet d'une évaluation des tests de la fonction hépatique (TFH) initiaux [alanine aminotransférase (ALAT) sérique, aspartate aminotransférase (ASAT), bilirubine sérique totale (BILT) et phosphatase alcaline (PAL)].
Il faudra éliminer une pathologie obstructive des voies biliaires en cas d'augmentation des concentrations d'ALAT et d'ASAT ou en cas d'antécédents de traitement par tout analogue de la somatostatine. L'administration du pegvisomant devra être arrêtée si les signes ou symptômes de dysfonctionnement hépatique persistent.
per raccomandazioni relative all'istituzione di Somavert in base ai test della funzione epatica iniziale (TFH) e alle raccomandazioni relative al monitoraggio dei test di funzionalità epatica durante il trattamento con Somavert, Tabella A.
| TFH Iniziali |
Raccomandazioni |
| Normale |
|
| rimodellati, ma inferiore o uguale a 3 volte l'LSN || Somavert; Tuttavia, un monitoraggio mensile di THF deve essere effettuato per almeno 1 anno dopo l'introduzione del trattamento, quindi due volte l'anno l'anno successivo. |
|
| = maggiore di 3 volte l'LSN |
|
Abbreviazioni: alat = alanina aminotransferasi; Asat = aspartato aminotransferasi; TFH = test della funzione epatica; LSN: limite superiore al normale.
Se un paziente ha aumenti di TFH o qualsiasi altro segno o sintomo della disfunzione epatica durante il trattamento con Somavert, si raccomanda la seguente gestione (Tabella B).
| TFH e segni/sintomi clinici |
Raccomandazioni |
| rimosso, ma meno o uguale a 3 volte l'LSN |
|
| maggiore di 3 ma meno di 5 volte l'LSN (senza segni/sintomi di epatite o altra lesione epatica, o aumento dell'angolo sierico) |
|
| == 5 volte l'LSN o aumenti transaminati di almeno 3 volte l'LSN associato ad un aumento del siero di gamma (con o senza segni/sintomi di epatite o altri danni al fegato) |
|
| segni o sintomi evocativi di epatite o altri danni al fegato (ad es. Jaundar, bilirubinuria, fatica, nausea, vomito, dolore in alto a destra, ascite, edema inspiegabile, trauma) || 958 |
|
Ipoglicemia
Lo studio condotto con il pegvisomante nei pazienti diabetici trattati con insulina o mediante ipoglicemia ipoglicemica orale in questa popolazione. Di conseguenza, nei pazienti acromegali e diabetici, può essere necessaria una riduzione delle dosi di insulina o ipoglicemia orale (vedere Sezione Interazioni).
= Miglioramento della fertilità
Benefici terapeutici di una riduzione della concentrazione di IGF-1, guidando un miglioramento della condizione clinica dei pazienti, potrebbero anche migliorare la fertilità dei pazienti (vedere Sezione Fertilità/gravidanza/allattamento al seno).
gravidanza
Il controllo dell'acromegalia può migliorare durante la gravidanza. Il pegvisomant non è raccomandato durante la gravidanza (vedere la sezione Fertilità/gravidanza/allattamento al seno). Se durante la gravidanza viene utilizzato il PEGVisomant, i livelli di IGF-I devono essere attentamente monitorati e potrebbe essere necessario regolare le dosi di PEGVisomant (vedere Sezione Dosaggio e modalità di somministrazione) in funzione dei valori di IGF-I.
meno di 1 mmol di sodio (23 mg) per dose. I pazienti che seguono una dieta iposofila possono essere informati che questo farmaco è "essenzialmente senza sodio".
Ce médicament contient moins de 1 mmol de sodium (23 mg) par dose. Les patients suivant un régime hyposodé peuvent être informés que ce médicament est « essentiellement sans sodium ».
interazioni |
Connect per accedere a questo contenuto
Fertilità/gravidanza/allattamento |
gravidanza
la donna incinta. Gli studi condotti negli animali non sono sufficienti per consentirci di concludere sulla tossicità sulla riproduzione (vedere la sezione Sicurezza preclinica).
Somavert non è raccomandato durante la gravidanza e nelle donne in età di procreazione non utilizzano la contraccezione. | Le tariffe IGF-I dovrebbero essere attentamente monitorate, specialmente durante il primo trimestre. Potrebbe essere necessario regolare la dose di pegvisomant durante la gravidanza (vedere la sezione
Si le pegvisomant est utilisé pendant la grossesse, les taux d'IGF-I doivent être étroitement surveillés, en particulier pendant le premier trimestre. Il peut être nécessaire d'ajuster la dose de pegvisomant pendant la grossesse (voir rubrique Avvertenze e precauzioni per l'uso).
allattamento al seno
L'escrezione di pegvisamant nel latte materno non è stata studiata negli animali. I dati clinici sono troppo limitati (un caso riportato) per concludere che l'escrezione di PEGVisomant nel latte materno umano. Pertanto, il pegvisomante non dovrebbe essere usato nelle donne che allattano. Tuttavia, l'allattamento al seno può essere continuato se questo farmaco viene interrotto: questa decisione deve tener conto del beneficio del trattamento da parte di PEGVISOMANT per la madre e del beneficio dell'allattamento al seno per il bambino.
Fertilità
Nessun dato sulla fertilità è disponibile per PEGVisamant. | Portando a un miglioramento delle condizioni cliniche dei pazienti, potrebbe anche migliorare la fertilità dei pazienti.
Les bénéfices thérapeutiques d'une réduction de la concentration d'IGF-1, conduisant à une amélioration de l'état clinique des patients, pourraient également améliorer la fertilité des patientes.
guida e utilizzo di macchine |
Gli effetti sulla capacità di guidare i veicoli e di utilizzare le macchine non sono stati studiati.
= Effetti indesiderati |
Connect per accedere a questo contenuto
overdose |
L'esperienza di un sovradosaggio con il pegvisomante è limitata. È stato segnalato un singolo caso di sovradosaggio acuto per il quale un paziente, avendo ricevuto 80 mg/die per 7 giorni, ha presentato una leggera affaticamento e siccità aggiuntive dalla bocca. Nella settimana successiva al trattamento, sono stati notati i seguenti effetti collaterali: insonnia, affaticamento aggiuntivo, edema periferico, tremori e aumento di peso. Due settimane dopo l'interruzione del trattamento, sono state osservate leucocitosi e emorragia moderata nei siti di iniezione o di puntura venosa, che possono essere considerati attribuibili al pegvisomante.
En cas de surdosage, l'administration de ce médicament doit être interrompue et ne doit pas être reprise avant que les taux d'IGF-1 ne soient revenus dans la fourchette normale ou au-dessus de celle-ci.
Farmacodinamica |
= Connect per accedere a questo contenuto
Pharmacokinetics |
Connettiti per accedere a questo contenuto
Preclinic Security |
I dati non clinici derivanti da studi tossicologici nella somministrazione ripetuta nei ratti e nella scimmia non hanno rivelato alcun rischio particolare per l'uomo. Tuttavia, a causa della marcata risposta farmacologica in scimmia, le esposizioni sistemiche superiori a quelle colpite nei pazienti trattate a dosi terapeutiche non sono state studiate.
Nello studio di carcinogenesi nei ratti, istiocitomi fibrosi maligni, associati alla fibrosi e infiammazione istiocitica, sono stati osservati in siti di iniezione nei maschi e questo a livelli di esposizione tre volte superiore all'esposizione negli esseri umani sulla base delle concentrazioni plasmatiche medie ottenute durante due studi a lungo termine a un dose quotidianamente a un dose quotidianamente a un dose quotidianamente a un dose quotidianamente a un dose quotidiano a una dose quotidiana a una dose giornaliera di una dose quotidiana di una dose quotidiana di un dose giornaliero di 30 mg. La rilevanza clinica di questa osservazione per l'uomo non è nota. L'aumentata incidenza dei tumori nel sito di iniezione è stata probabilmente causata dall'irritazione e dalla grande sensibilità del ratto alle iniezioni sottocutanee ripetute.
Des études sur le développement embryonnaire précoce et le développement embryo-fœtal ont été menées chez des lapines gravides avec du pegvisomant à des doses sous-cutanées de 1, 3 et 10 mg/kg/jour. Il n'y a pas eu de preuve d'effets tératogènes associés à l'administration du pegvisomant pendant l'organogenèse. À la dose de 10 mg/kg/jour (6 fois la dose thérapeutique maximale chez l'Homme en fonction de la surface corporelle), une augmentation des pertes post-implantation a été observée dans les deux études. Aucune étude sur la fertilité n'a été menée.
incompatibilità |
In assenza di studi di compatibilità, questo farmaco non deve essere miscelato con altri farmaci.
Conservazione degli ufficiali |
3 anni.
Dopo la ricostituzione, il prodotto deve essere utilizzato immediatamente. | Conservazione specifica
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
Mantieni le bottiglie di polvere in frigorifero (tra 2 ° C e 8 ° C). Non congelare. Mantieni le bottiglie nel loro imballaggio al riparo dalla luce.
L'imballaggio contenente le bottiglie di polvere Somavert può essere mantenuta a temperatura ambiente fino a un massimo di 25 ° C per un singolo periodo di 30 giorni al massimo. La scadenza per l'uso deve essere registrata sulla confezione (fino a 30 giorni dalla data di rilascio del frigorifero). Le bottiglie devono essere tenute lontano dalla luce e non devono essere somministrate in frigorifero. Le bottiglie di polvere Somavert devono essere lanciate se non vengono utilizzate entro 30 giorni dallo stoccaggio a temperatura ambiente o alla data di scadenza stampata sulla confezione, secondo il primo verificarsi.
Mantenere siringhe pre -riempite a una temperatura non superiore a 30 ° C o in frigorifero (tra 2 ° C e 8 ° C). Non congelare.
Dopo la ricostituzione:
Per le condizioni di conservazione del farmaco dopo la ricostruzione, vedere la sezione Durata della conservazione.
Precauzioni di eliminazione e manipolazione di ondsliking |
La seringue et l'aiguille de sécurité utilisées pour l'administration de l'injection sont fournies avec le médicament.
Rimuovere il cappuccio dalla siringa pre -riempita prima di montare l'ago di sicurezza fornito rompendo il cappuccio. La siringa deve essere mantenuta in una posizione verticale per evitare un flusso. Evita il contatto con la fine della siringa con qualsiasi cosa.

La polvere deve essere ricostruita con 1 ml di solvente. Per l'aggiunta del solvente a siringa, tenere la bottiglia e la siringa inclinata come illustrato nella figura seguente.
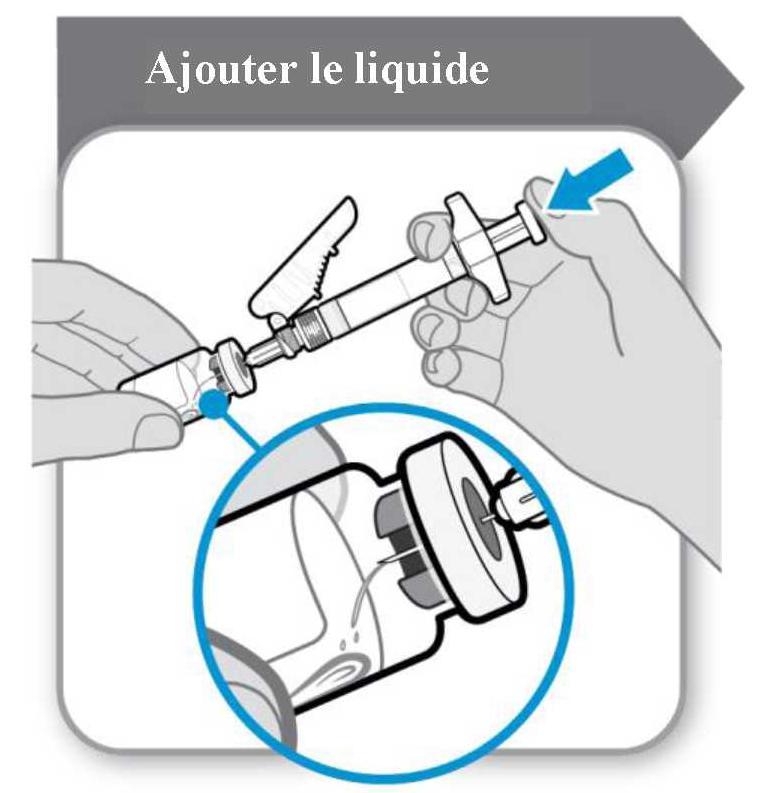
Aggiungi il solvente alla bottiglia in polvere. Il solvente deve essere trasferito lentamente alla bottiglia per evitare il rischio di formazione di schiuma. Ciò renderebbe il farmaco inutilizzabile. Sciogliere delicatamente la polvere con un movimento a rotazione lenta. Non agitare vigorosamente perché potrebbe distorcere la sostanza attiva.
Dopo la ricostruzione, la soluzione ricostituita deve essere ispezionata visivamente per garantire l'assenza di particelle esterne (o estranee) e qualsiasi anomalie dell'aspetto fisico prima della somministrazione. In caso contrario, il farmaco deve essere distrutto.
= Rimuovere l'ago verso il basso in modo che l'estremità dell'ago nel liquido. Indietro lentamente lungo il pistone della siringa per prendere il farmaco dalla bottiglia. In caso di presenza aerea nella siringa, tocca il cilindro della siringa per far apparire le bolle, quindi espellere delicatamente le bolle nella bottiglia.

Reculer l'aiguille vers le bas de manière à ce que l'extrémité de l'aiguille soit positionnée au point le plus bas dans le liquide. Reculer lentement le piston de la seringue pour prélever le médicament du flacon. En cas de présence d'air dans la seringue, tapoter le cylindre de la seringue pour faire remonter les bulles, puis expulser délicatement les bulles dans le flacon.
Prima di eliminare la siringa e l'ago, piegare la protezione dell'ago sull'ago e assicurarsi che sia adeguatamente bloccato (sentiamo un clic). Non riutilizzare mai la siringa e l'ago.
per uso singolo. Eventuali farmaci inutilizzati o di scarto devono essere eliminati in conformità con i regolamenti in vigore.
prescrizione/consegna/cura |
| AMM |
|
| Prezzo: |
|
| AMM |
|
| Prezzo: |
|
| AMM |
|
| Prezzo: |
|
| AMM |
|
| Prezzo: |
|
REWER 100 %. Raccogliere.
| AMM |
|
| Prezzo: |
|