Inserisci almeno 3 caratteri per la tua ricerca.
Riepilogo
Excipient del solvente:= PPI
EEN sans dose seuil : Polysorbate 80
EEN con dose di soglia: Sodio
CIP: 3400955004011
Metodi di conservazione: prima dell'apertura: <30 ° per 36 mesi (non congelare)
FORMES et PRÉSENTATIONS |
RIXUBIS 250 UI, polvere e solvente per soluzione iniettabile
polvere (bianco a bianco rotto) e solvente (limpido e incolore) per una soluzione di iniezione.
Scatola di contatto: 1 bottiglia in polvere+1 bottiglia di solvente da 5 ml+1 dispositivo ago senza ago Baxject II.
RIXUBIS 500 UI, polvere e solvente per soluzione iniettabile
polvere (bianco a bianco rotto) e solvente (limpido e incolore) per una soluzione di iniezione.
= scatola contenente: 1 bottiglia in polvere+1 bottiglia di 5 ml di solvente+1 dispositivo senza ago senza ago senza ago baxject II.
Rixubis 1 000 UI, polvere e solvente per soluzione di iniezione
polvere (bianco a bianco rotto) e solvente (limpido e incolore) per una soluzione di iniezione.
= scatola contenente: 1 bottiglia in polvere+1 bottiglia di 5 ml di solvente+1 dispositivo senza ago senza ago Baxject II.
Rixubis 2.000 UI, polvere e solvente per soluzione di iniezione
polvere (bianco con bianco rotto) e solvente (limpido e incolore) per una soluzione di iniezione.
= scatola contenente: 1 bottiglia in polvere+1 5 ml di solvente+1 baxject II.
RIXUBIS 3000 UI, polvere e solvente per soluzione iniettabile
polvere (bianco a bianco rotto) e solvente (limpido e incolore) per una soluzione di iniezione.
Boîte contenant : 1 flacon de poudre + 1 flacon de 5 ml de solvant + 1 dispositif de reconstitution sans aiguille Baxject II.
Composizione |
Rixubis 250 UI, polvere e solvente per soluzione di iniezione
Un flacon contient une quantité nominale de 250 UI de nonacog gamma, facteur IX de coagulation humain recombinant (ADNr), correspondant à une concentration de 50 UI/ml après reconstitution avec 5 ml de solvant.
RIXUBIS 500 UI, polvere e solvente per soluzione iniettabile
Un flacon contient une quantité nominale de 500 UI de nonacog gamma, facteur IX de coagulation humain recombinant (ADNr), correspondant à une concentration de 100 UI/ml après reconstitution avec 5 ml de solvant.
RIXUBIS 1 000 UI, poudre et solvant pour solution injectable
Un flacon contient une quantité nominale de 1 000 UI de nonacog gamma, facteur IX de coagulation humain recombinant (ADNr), correspondant à une concentration de 200 UI/ml après reconstitution avec 5 ml de solvant.
RIXUBIS 2 000 UI, poudre et solvant pour solution injectable
Un flacon contient une quantité nominale de 2 000 UI de nonacog gamma, facteur IX de coagulation humain recombinant (ADNr), correspondant à une concentration de 400 UI/ml après reconstitution avec 5 ml de solvant.
rixubis 3 000 UI, polvere e solvente per soluzione iniettabile || 671 == Vial contiene una quantità nominale di 3.000 IUS da gamma non acog, un fattore di coagulazione umana ricombinante (DNA), corrispondente a una concentrazione di 600 UI/mL dopo ricostruzione con 5 mL di solvente.
Un flacon contient une quantité nominale de 3 000 UI de nonacog gamma, facteur IX de coagulation humain recombinant (ADNr), correspondant à une concentration de 600 UI/ml après reconstitution avec 5 ml de solvant.
L'attività (IU) è determinata usando il test di coagulazione in una farmacopea europea. L'attività specifica di Rixubis è di circa 200-390 UI/mg di proteina.
Gamma non ACOG (fattore di coagulazione ricombinante IX) è una glicoproteina a catena a catena singola che comprende 415 aminoacidi. È prodotto dalla tecnologia del DNA ricombinante su una linea cellulare di ovaio di criceto cinese (CHO).
Excipient (i) con un effetto noto:
Una bottiglia contiene 19 mg di sodio.
Polvere: | Mannitolo, cloruro di sodio, cloruro di calcio, L-istidina, polisorbato 80. saccharose, mannitol, chlorure de sodium, chlorure de calcium, L-histidine, polysorbate 80.
solvente: Acqua per preparati iniettabili sterilizzati.
Indicazioni |
= Trattamento e profilassi dell'emorragia nei pazienti con emofilia (deficit congenito nel fattore IX). || 710
RIXUBIS est indiqué chez les patients dans toutes les tranches d'âge.
dosaggio e modalità di amministrazione |
Connect per accedere a questo contenuto
Contraindicazioni || 731 |
Connectez-vous pour accéder à ce contenu
Avvertimenti e precauzioni per l'uso |
Traceability
Per migliorare la tracciabilità dei farmaci biologici, il nome e il numero batch del prodotto somministrato devono essere chiaramente registrati.
Ipersensibilità
con rixubis. Il prodotto contiene tracce di proteina del criceto. In caso di sintomi di ipersensibilità, i pazienti o i loro caregiver devono fermare immediatamente i farmaci e consultare il proprio medico.
I pazienti devono essere informati dei primi segni di reazioni di ipersensibilità come eruzioni orticarie, orticaria generalizzata, oppressione toracica, anafilassi di Sibulances.
Il rischio è massimo durante le prime fasi di esposizione iniziale ai concentrati del fattore IX nei pazienti precedentemente trattati (PNTP), in particolare in quelli con mutazioni genetiche ad alto rischio. Gli studi hanno riportato un'associazione tra la comparsa di un inibitore del fattore IX e reazioni allergiche, specialmente nei pazienti con mutazione genetica ad alto rischio. I pazienti con reazioni allergiche devono quindi essere valutati al fine di rilevare la presenza di un inibitore.
In caso di shock, è necessario implementare un trattamento medico standard dello shock.
inibitori
Après un traitement répété par des produits à base de facteur IX de coagulation humain (ADNr), les patients doivent être suivis afin de détecter la formation d'anticorps neutralisants (inhibiteurs) qui doivent être quantifiés en unités Bethesda (UB) à l'aide de tests biologiques appropriés.
Studi hanno riportato una correlazione tra la formazione di un inibitore del fattore IX e le reazioni allergiche. I pazienti con reazioni allergiche dovrebbero quindi essere valutati per rilevare la presenza di un inibitore. Va notato che i pazienti con inibitori del fattore IX possono correre un rischio più elevato di anafilassi in caso di somministrazione successiva del fattore IX.
En raison du risque de réactions allergiques avec des concentrés de facteur IX, les premières administrations de facteur IX doivent, selon le jugement du médecin traitant, être effectuées sous observation médicale dans un environnement permettant de prodiguer les soins appropriés en cas de réaction allergique.
Sindrome nefrotica
casi di sindrome nefrotica sono stati segnalati dopo un tentativo di induzione della tolleranza immunitaria nei pazienti con emofilia B e con inibitori del fattore IX. | Le complicanze trombotiche, la sorveglianza clinica volta a rilevare i primi segni di coagulopatia di consumo e trombosi dovrebbero essere impostate con appropriati test biologici durante la somministrazione di questo prodotto a pazienti con patologie epatiche, pazienti nella fase post-operatoria, neonati o pazienti con un rischio di fenomenone o civoni trombotici. In ciascuna di queste situazioni, i benefici del trattamento con rixubis devono essere confrontati con il rischio di queste complicanze.
Thrombo-embolie
En raison du risque de complications thrombotiques, une surveillance clinique visant à détecter les premiers signes de coagulopathie de consommation et de thrombose doit être mise en place avec des tests biologiques appropriés lors de l'administration de ce produit à des patients atteints de pathologies hépatiques, à des patients en phase post-opératoire, à des nouveau-nés ou à des patients présentant un risque de phénomène thrombotique ou de CIVD. Dans chacune de ces situations, les bénéfices du traitement par RIXUBIS doivent être comparés au risque de survenue de ces complications.
Eventi cardiovascolari
La somministrazione del trattamento di sostituzione di un fattore IX può aumentare i rischi cardiovascolari nei pazienti con fattori di rischio cardiovascolare.
Complicazioni relative al catetere
Si un dispositif d'accès veineux central (DAVC) est requis, le risque de complications liées au DAVC, telles que des infections locales, une bactériémie et une thrombose au site du cathéter, doit être pris en compte.
Considerazioni legate agli eccipienti
Ce médicament contient moins de 1 mmol de sodium par flacon (23 mg), c'est-à-dire qu'il est essentiellement « sans sodium ». Selon le poids corporel et la posologie de RIXUBIS, il se peut qu'un patient reçoive plus d'un flacon. Ceci doit être pris en considération si le patient suit un régime hyposodé.
Elderly People
Studi clinici sui rixubis non hanno incluso soggetti di età pari o superiore a 65 anni. Non sappiamo se rispondono in modo diverso dai soggetti più giovani. Come in tutti i pazienti, la selezione della dose in un paziente anziano deve essere personalizzata.
Popolazione pediatrica
Gli avvertimenti e le precauzioni per l'uso menzionate si applicano ad adulti e bambini.
interazioni |
Connettiti pour accéder à ce contenu
Fertilità/gravidanza/allattamento |
gravidanza
Non ci sono dati in cui ci sono dati limitati sull'uso del fattore IX nelle donne in gravidanza. Nessuno studio di riproduzione sull'animale è stato condotto con il fattore IX. Di conseguenza, il fattore IX dovrebbe essere somministrato solo in caso di assoluta necessità durante la gravidanza e l'allattamento.
allattamento al seno
Non sappiamo se il fattore IX/metaboliti sia escreto nel latte materno.
Fertilità
Non esiste sugli effetti del fattore IX sulla fertilità.
guida e utilizzo di macchine |
Rixubis non ha alcun effetto sulla capacità di guidare i veicoli e utilizzare macchine.
Effetti avversi |
Connettiti per accedere a questo contenuto
Overdosage |
Les effets de doses de RIXUBIS supérieures à celles recommandées n'ont pas été décrits.
Farmacodinamica |
Connettiti per accedere a questo contenuto
Pharmacokinetics |
= Connettiti per accedere a questo contenuto
SÉCURITÉ PRÉCLINIQUE |
Rixubis non ha mostrato un rischio trombogenico per una dose di 750 UI/kg in un modello di stasi nei conigli (test di Wessler).
Rixubis non ha portato a effetti avversi cardiovascolari, respiratori o clinici alla dose di 450 UI/kg nel monitor Cynomolgus.
Non è stata condotta alcuna indagine su animali relativi alla cancerogenicità, ai disturbi della fertilità e allo sviluppo fetale.
Rixubis è stato ben tollerato durante gli studi di tossicità in dose singola e somministrazione ripetuta nella scimmia di topo, ratto e cinomolgus a dosi massime di 7.500 UI/ (dose singola) e 750 UI/ kg (somministrazione ripetuta).
incompatibilità |
In assenza di studi di compatibilità, questo farmaco non deve essere miscelato con altri farmaci.
utilizza solo siringhe Luer-Lock con questo prodotto. Una dose errata può essere dovuta a un adsorbimento del fattore IX della coagulazione umana da parte delle superfici interne di alcune apparecchiature di infusione.
ufficiale dello scaffale |
3 anni.
La stabilità fisico-chimica dopo l'apertura dell'imballaggio è stata dimostrata per 3 ore a una temperatura non superiore a 30 ° C. Da un punto di vista microbiologico, a meno che il metodo di ricostruzione non escluda qualsiasi rischio di contaminazione microbica, il prodotto deve essere utilizzato immediatamente. Se il prodotto non viene utilizzato immediatamente, l'utente sarà responsabile della durata e delle condizioni di conservazione. Non mettere in frigorifero.
Precauzioni di conservazione particolari |
da mantenere e trasportare a una temperatura non superiore a 30 ° C.
Non congelare.
Per le condizioni di conservazione del farmaco dopo la ricostituzione, vedere la sezione fuori dalla conservazione.
Precauzioni speciali per l'eliminazione e la manipolazione |
Rixubis deve essere somministrato per via endovenosa dopo la ricostituzione della polvere con il solvente fornito.
Ricostituzione
Asettico
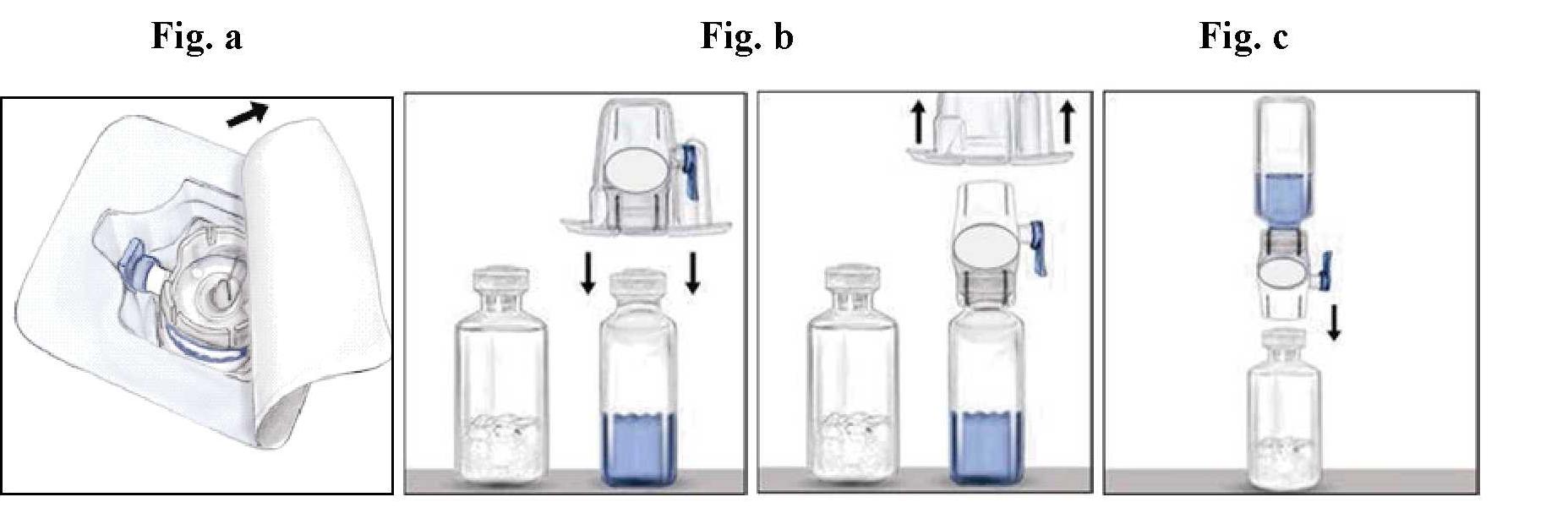
Non refrigerare la preparazione dopo la ricostruzione.
usa immediatamente.
amministrazione
Processo asettico Way
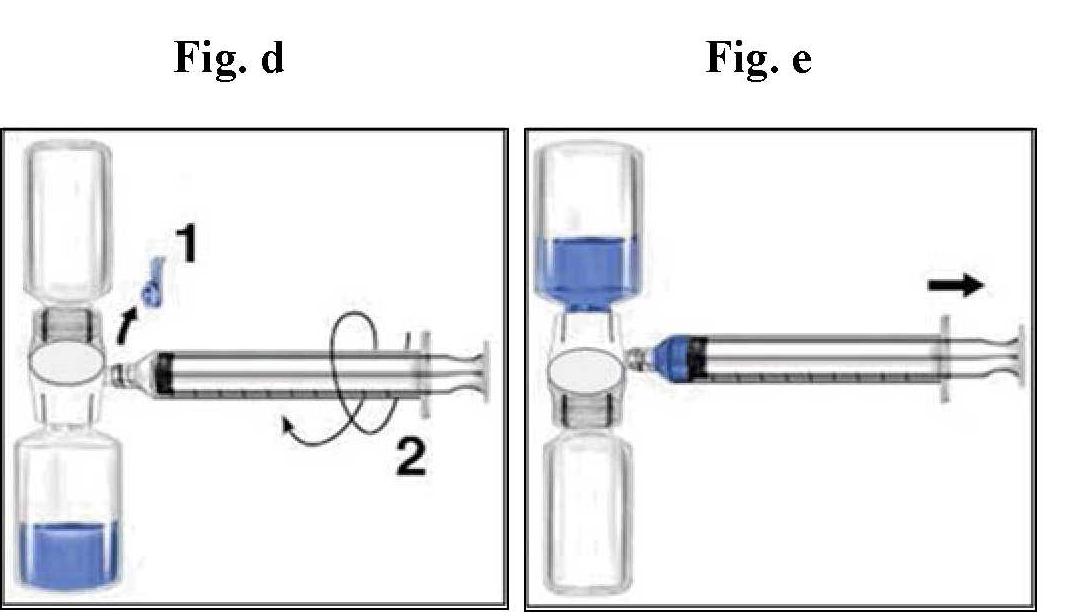
Se possibile, notare il nome del prodotto e il numero batch ogni volta che si utilizza rixubis (ad es. Nel taccuino) per garantire la tracciabilità dei prodotti e dei lotti utilizzati. | I regolamenti in vigore.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
prescrizione/consegna/cura |
| AMM |
|
| AMM |
|
| AMM |
|
| AMM |
|
| AMM |
|