Veuillez saisir au moins 3 caractères pour votre recherche.
Riepilogo
een senza soglia di dose: Etanolo al 96 %| Benzilique, alcool benzylique, Benzoato de benzil, Olio raffinato in ricina
CIP: 3400936349001
Metodi di conservazione: prima di aprire: 2 ° <8 ° per 4 anni (mantieni il riparo della luce, mantieni in frigorifero, mantieni nella sua confezione)
Presentazioni |
Composizione |
| P siringa | |
| Fulvestrant (DCI) | 250 mg |
Excipients à effet notoire (pour 5 ml) : éthanol (96 %, 500 mg), alcool benzylique (500 mg), benzoate de benzyle (750 mg).
Indicazioni |
dosaggio e modalità di amministrazione |
Connettiti per accedere a questo contenuto
Contraindicazioni |
Connettiti per accedere a questo contenuto
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
interazioni |
Accedi a questo contenuto pour accéder à ce contenu
Fertilità/Gravidanza/Affetto al seno |
I pazienti in età fertile devono utilizzare una contraccezione efficace durante il trattamento da parte di Faslodex e per 2 anni dopo aver ricevuto l'ultima dose.
Faslode Gravidancy ( CF Contraindications). Il fulvestrant attraversa la placenta dopo un'iniezione intramuscolare unica in milza e coniglio. Gli studi sugli animali hanno mostrato tossicità sulle funzioni di riproduzione, incluso un aumento dell'incidenza di anomalie e morti fetali ( CF Security preclinica). In caso di gravidanza durante il trattamento con Faslodex, il paziente deve essere avvertito del potenziale rischio per il feto e del potenziale rischio di aborto spontaneo.
L'allattamento al seno deve essere interrotto durante il trattamento con Faslodex. Il fulvestrant viene escreto nei ratti che allattano. Non ci sono dati sull'escrezione del fulvestrant nel latte materno. Dato il potenziale rischio potenziale di gravi effetti avversi del fulvestrant per il bambino allattato al seno, l'uso durante l'allattamento al seno è controindicato ( CF Controindications).
Fertilità:Gli effetti del Faslodex sulla fertilità nelle specie umane non sono stati studiati.
Guida e utilizzo di macchine |
Effetti indesiderati |
Connettiti per accedere a questo contenuto
ourdosage | Il sovradosaggio è stato segnalato con Faslodex nell'uomo. In caso di sovradosaggio, si raccomanda un trattamento sintomatico. Durante gli studi sugli animali, nessun effetto diverso da quelli collegati direttamente o indirettamente all'attività anti-estrogeni è stato evidenziato a dosi più elevate di fulvestrant ( |
Des cas isolés de surdosage ont été rapportés avec Faslodex chez l'humain. En cas de surdosage, un traitement symptomatique est recommandé. Au cours des études chez l'animal, aucun effet autre que ceux liés directement ou indirectement à l'activité anti-estrogène n'a été mis en évidence à des doses plus élevées de fulvestrant ( CF Sicurezza preclinica).
Farmacodinamica |
Contenuto pour accéder à ce contenu
Pharmacokinetics |
Connettiti per accedere a questo contenuto
Presslinic Safety |
La tossicità acuta del fulvestrant è debole. | studiato durante più studi. Le reazioni locali al sito di iniezione, tra cui miosite e granuloma, sono state attribuite agli eccipienti, ma la gravità della miosite nei conigli è stata più importante nel gruppo fulvestrant che nel gruppo di controllo (soluzione salina).
Faslodex, comme les autres formulations de fulvestrant, a été bien toléré dans les espèces animales étudiées lors des études à doses multiples. Des réactions locales au site d'injection, incluant myosite et granulome, ont été attribuées aux excipients, mais la sévérité de la myosite chez le lapin a été plus importante dans le groupe fulvestrant que dans le groupe contrôle (solution saline).
Durante gli studi di tossicità mediante somministrazione intramuscolare ribadita condotta in ratti e cani, la maggior parte degli effetti femminili di organi riproduttivi ma anche sugli organi ormonali di entrambi i sessi, potrebbe essere attribuita all'attività anti-estrogenica del fulvestrante. L'arterite a livello di diversi tessuti è stata osservata in diversi cani dopo la somministrazione cronica (12 mesi).
Negli studi sui cani, dopo la somministrazione orale o endovenosa, sono stati osservati effetti sul sistema cardiovascolare: una leggera estensione del segmento S-T dell'elettrocardiogramma (percorso orale) e della pausa del seno in un cane (via endovenosa). Questi effetti sono apparsi per un'esposizione superiore a quelli utilizzati nei pazienti (CMAX> 15 volte) e sono considerati non molto significativi in termini di lavoro per le specie umane nelle dosi cliniche.
Il fulvestrant ha mostrato qualsiasi potenziale genotossico.
Gli effetti osservati, in dosi simili alle dosi cliniche, sulla riproduzione e sullo sviluppo embrionale e fetale sono la conseguenza dell'attività anti -estrogeni del fulvestrant.
Nei ratti, una riduzione reversibile della fertilità delle femmine, una diminuzione della sopravvivenza embrionale, della distocia e un aumento della frequenza dei fetelli anomalie, compresa la curvatura del tarso. Nei conigli avendo ricevuto il fulnshunting, la gestazione non poteva essere mantenuta. È stato osservato un aumento del peso della placenta e delle perdite post -impianti. Nei conigli, c'è stato un aumento dell'incidenza delle modifiche fetali (dondolo all'indietro del bacino e della vertebra pre -sacorata 27).
Une étude de cancérogénicité de deux ans chez les rats (administration intramusculaire de Faslodex) a mis en évidence une augmentation de la fréquence des tumeurs ovariennes bénignes des cellules de la granulosa chez les rats femelles pour de fortes doses de 10 mg/rat/15 jours, et une augmentation des tumeurs des cellules testiculaires de Leydig chez les mâles. Lors d'une étude de cancérogénicité de deux ans chez la souris (administration orale quotidienne), il y a eu une augmentation de l'incidence des tumeurs du stroma et des cordons sexuels de l'ovaire (à la fois bénignes et malignes) à des doses de 150 et 500 mg/kg/jour. A la dose sans effet pour ces événements, les niveaux d'exposition systémique (ASC) étaient, chez les rats, approximativement 1,5 fois les niveaux d'exposition attendus chez la femme et 0,8 fois chez l'homme et, chez les souris, approximativement 0,8 fois les niveaux d'exposition attendus à la fois chez l'homme et chez la femme. L'induction de telles tumeurs est cohérente avec les modifications pharmacologiques endocriniennes des taux de gonadotropine provoquées par les anti-estrogènes chez des animaux en activité hormonale. De ce fait, ces résultats ne sont pas considérés comme significatifs dans le cadre de l'utilisation du fulvestrant chez des femmes ménopausées souffrant d'un cancer du sein au stade avancé.
incompatibilità |
In assenza di studi di compatibilità, questo medicinale non deve essere miscelato con altri farmaci.
Reades of Conservation |
4 anni. 4 ans.
da mantenere e trasportare al frigorifero (tra 2 ° C e 8 ° C).
Le escursioni di temperatura al di fuori di 2 ° C-8 ° C devono essere limitate. La conservazione a temperature superiori a 30 ° C è esclusa e il tempo di conservazione a una temperatura media per il prodotto inferiore a 25 ° C (ma maggiore di 2 ° C-8 ° C) non deve superare i 28 giorni. Dopo le escursioni di temperatura, il prodotto deve essere posizionato immediatamente nelle condizioni di conservazione raccomandate (da preservare e trasportare in frigorifero tra 2 ° C e 8 ° C). Le escursioni di temperatura hanno un effetto cumulativo sulla qualità del prodotto e la durata di 28 giorni non deve essere superata durante la durata di conservazione di 4 anni di Faslodex. L'esposizione a temperature inferiori a 2 ° C non danneggerà il prodotto soggetto a non conservarlo al di sotto di -20 ° C.
Mantieni la siringa pre -riempita nella confezione originale per proteggerla dalla luce.
Manipolazione/eliminazione delle modalità |
| Figura 1 |
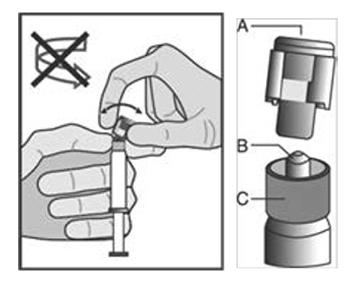 |
| Figura 2 |
 |
| Figura 3 |
 |
| Figura 4 |
 |
| Figura 5 |
 |
prescrizione/consegna/supporto |
| AMM | EU/1/03/269/001; CIP 3400936349001 (2004, RCP Rev 02.04.2020). |
| Prezzo: | 184,67 euro (1 siringa). |
| REMB SOC SOC 100 % sulla base di TFR: 92,89 euro (1 siringa) e raccogli nell'indicazione: "Nella monoterapia nel trattamento del carcinoma mammario avanzato localmente metastatico, positivo per i recettori degli estrogeni, nelle donne in menopausa con una ricorrenza durante o dopo un trattamento adiuvante con un antostrogeno o una progressione di malattia antidestrogena". | |
| nelle altre indicazioni: richieste allo studio alla data del 02.01.2023. | |
Titulaire de l'AMM : Astrazeneca AB, SE-151 85 Södertälje, Svezia.
