Inserisci almeno 3 caratteri per la tua ricerca.
Riepilogo
een senza soglia di dose: Polysorbate 80, gomma
CIP: 3400930268636
Metodi di conservazione: Prima di aprire: 2 °
forme e presentazioni | 50 mg di soluzione solida iniettabile in siringa pre -riempita |
BEYFORTUS 50 mg solution injectable en seringue préremplie
Soluzione iniettabile (limpida a opalescente, incolore al giallo, da pH 6.0).
= contenente: 1 siringa pre -uso pre -uso per aghi distinti a uso singolo di dimensioni diverse.
Beyfortus 100 mg pre -riempiti
SOLUZIONE APENSABILE (limpida a opalescente, incolore al giallo, da pH 6.0).
= Casella contenente: 1 siringa pre -uso pre -riempita per uso singolo di utilizzo +2 aghi distinti di dimensioni diverse.
Composizione |
Beyfortus 50 mg pre -riempiti
Ogni siringa pre -riempita contiene 50 mg di Nirsévimab in 0,5 mL (100 mg/mL).
Beyfortus 100 mg Soluzione iniettabile nella siringa pre -riempita
Ogni siringa pre -riempita contiene 100 mg di Nirsévimab in 1 ml (100 mg/mL).
Nirsévimab è un anticorpo monoclonale umano di immunoglobulina di tipo G1 kappa (IgG1 κ) prodotto nelle cellule ovarie del criceto cinese (CHO) dalla tecnologia del DNA ricombinante.
EXPIPIENTS con effetto noto
Ce médicament contient 0,1 mg de polysorbate 80 (E433) pour chaque dose de 50 mg (0,5 mL) et 0,2 mg pour chaque dose de 100 mg (1 mL) (voir rubrique Mises en garde et précautions d'emploi).
L-istidina, L-istidina cloridrato, l-arginina cloridrata, sacharose, polisorbato 80 (E433), acqua per preparazioni iniettabili.
Indicazioni |
Beyfortus è indicato per la prevenzione di infezioni del tratto respiratorio inferiore a causa del virus respiratorio sinciziale (VRS) in:
Beyfortus deve essere utilizzato in conformità con le raccomandazioni ufficiali in vigore.
dosaggio e metodo di amministrazione |
Accedi a questo contenuto pour accéder à ce contenu
Contraindicazioni |
Connettiti per accedere a questo contenuto
Avvertimenti e precauzioni per l'uso |
Traceability
Per migliorare la tracciabilità dei farmaci biologici, il nome e il numero batch. Salvato.
Ipersensibilità, in particolare anafilassi
di gravi reazioni di ipersensibilità, sono stati segnalati a seguito della somministrazione di Beyfortus. Sono stati osservati casi di anafilassi con anticorpi monoclonali dell'immunoglobulina umana G1 (IgG1). In caso di comparsa di segni e sintomi di anafilassi o altra reazione clinicamente significativa dell'ipersensibilità, fermare immediatamente la somministrazione e avviare un trattamento farmacologico e/o un'adeguata cure di supporto.
Disturbi emorragici clinicamente significativi
Per quanto riguarda tutti i farmaci iniettabili intramuscolari (IM), durante la somministrazione di Nirsévimab a individui con trombocitopenia o un disturbo di coagulazione.
bambini immunocompromessi
In alcuni bambini immunocompromessi che presentano patologie con perdita di proteine, durante gli studi clinici è stata osservata un'elevata clearance di Nirsévimab (vedi Sezione || Pharmacokinetics) e i Nirsévimab potrebbero non portare lo stesso livello di protezione in questi individui.
Polysorbate 80 (E433)
Questo farmaco contiene 0,1 mg di polisorbato 80 per ciascuna dose di 50 mg (0,5 mL) e 0,2 mg per ogni dose di 100 mg (1 mL). I polisorbati possono provocare reazioni allergiche.
interazioni |
Connettiti per accedere a questo contenuto
Effetti indesiderati |
Connettiti per accedere a questo contenuto
ourdosage |
Il n'existe pas de traitement spécifique en cas de surdosage avec du nirsévimab. En cas de surdosage, il convient de surveiller la survenue d'effets indésirables chez le patient et de lui administrer un traitement symptomatique approprié.
Farmacodinamica |
Connettiti per accedere a questo contenuto
Farmacocinetica |
a questo contenuto pour accéder à ce contenu
Preclinic Security |
I dati non clinici derivanti dagli studi sulla farmacologia della sicurezza, nella tossicologia nella somministrazione ripetuta e nella reattività dei tessuti trasversali non hanno rivelato alcun rischio particolare per l'uomo.
incompatibilità |
In assenza di studi di compatibilità, questo farmaco non deve essere miscelato con altri medicinali.
Durata di conservazione |
3 anni
Beyfortus può essere mantenuto a temperatura ambiente (20 ° C-25 ° C) riparata dalla luce per 8 ore al massimo. Una volta trascorsa questa volta, la siringa deve essere gettata via.
Precauzioni di conservazione speciale |
da mantenere in frigorifero (tra 2 ° C e 8 ° C).
Non congelare.
Non agitare e non esporre al calore diretto. | Pre -riempito nella confezione esterna nel rifugio della luce.
Conserver la seringue préremplie dans l'emballage extérieur à l'abri de la lumière.
Per le condizioni di conservazione del farmaco, vedere la sezione fuori dalla conservazione.
= Precauzioni particolari per l'eliminazione e la manipolazione |
Questo farmaco deve essere somministrato da un professionista sanitario addestrato la sterilità del prodotto.
Controllo a occhio nudo che il farmaco non ha particelle o scolorimento prima della somministrazione. Il farmaco è una soluzione chiara per opalescente, incolore al giallo. Non iniettare se il liquido è turbato, scolorito o se contiene particelle di grandi dimensioni o corpi estranei.
Non utilizzare se la siringa pre -riempita è caduta o è danneggiata o se il giunto di sicurezza sulla confezione esterna è stato rotto.
= Istruzioni relative all'amministrazione
Beyfortus è disponibile sotto forma di una pre -Proced 50 mg e una siringa pre -riempita di 100 mg. Controllare le etichette bloccate sulla confezione esterna e sulla siringa pre -riempita per assicurarti di aver scelto la presentazione corretta richiesta di 50 mg o 100 mg.
= Siringa preremplificata di Beyfortus 50 mg (50 mg/0,5 ml) con asta di pistone viola. | (100 mg/1 ml) con asta a pistone azzurro. |
Seringue préremplie de Beyfortus 100 mg (100 mg/1 mL) avec tige de piston bleu clair. |
|
|
|
|
Vedi nella Figura 1 i componenti della siringa pre -riempita.
Figura 1: Componenti della siringa Luer Lock
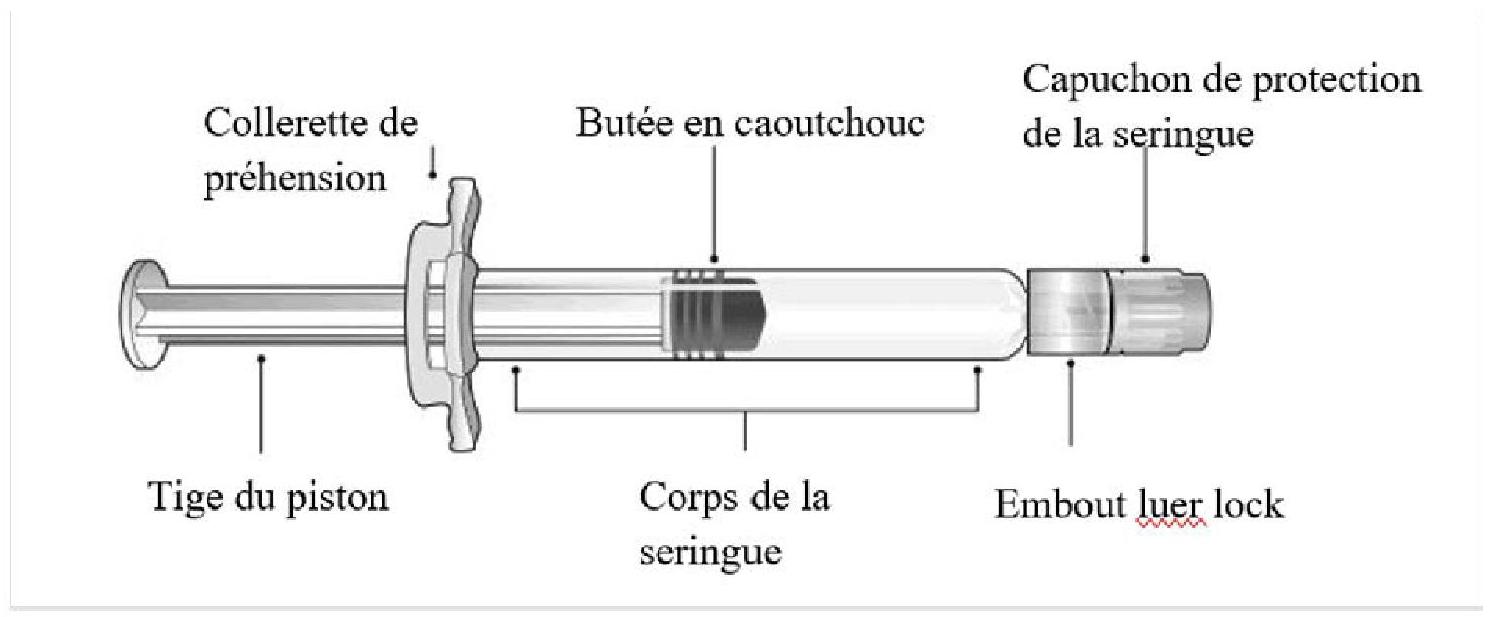
Passaggio 1: En tenant le Luer Lock d'une main (éviter de tenir la tige du piston ou le corps de la seringue), dévisser le capuchon de protection de la seringue en le tournant dans le sens anti-horaire avec l'autre main.
Passaggio 2: Attacco un ago sulla siringa pre-riempita, gira delicatamente l'ago, nella direzione dell'ora sul blocco Luer Loer della siringa Preremplie, per soddisfare una leggera resistenza.
Passaggio 3: tenendo il corpo della siringa con una mano, tira delicatamente il tappo protettivo dell'ago con l'altra mano per rimuoverlo. Non tenere l'asta del pistone durante la rimozione del cappuccio protettivo dall'ago, a rischio di spostare la fermata della gomma. Non toccare l'ago e non metterlo in contatto con una superficie. Non mettere il cappuccio protettivo sull'ago e non rimuovere l'ago dalla siringa.
Passaggio 4: Somministrare tutto il contenuto della siringa pre -riempita nell'iniezione intramuscolare, preferibilmente nel lato anterolaterale della coscia. Il muscolo del gluteo non deve essere sistematicamente utilizzato come sito di iniezione a causa del rischio di lesione del nervo sciatico.
Passaggio 5:= getta immediatamente la siringa usata, nonché l'ago, in un contenitore per oggetti affilati o in conformità con i requisiti locali. | a 5 in un altro sito di iniezione.
Si deux injections sont nécessaires, répétez les étapes 1 à 5 dans un site d'injection différent.
eliminazione
Ogni siringa pre -riempita è per uso singolo. Eventuali farmaci inutilizzati o di scarto devono essere eliminati in conformità con i regolamenti in vigore.
prescrizione/consegna/cura |
| AMM |
|
| Prezzo: |
|
Approvato a comunità e SOC SECS al 30 % solo nelle indicazioni:
| AMM |
|
| Prezzo: |
|
: :
approvato alle comunità. Board SEC SOC al 30 % nelle indicazioni:
Dans l'indication "Prévention des infections des voies respiratoires inférieures dues au virus respiratoire syncytial (VRS) chez les enfants jusqu'à l'âge de 24 mois qui demeurent vulnérables à une infection sévère due au VRS au cours de leur deuxième saison de circulation du VRS":
non rimborsabile e non approvato Raccolta alla data du 24.06.2025 (richieste di ammissione allo studio).

Campagna 2025-2026 della prevenzione delle infezioni nei VR: vaccino Abrysvo o anticorpo monoclonale
Immunizzazione contro il VRS: fine della campagna 2024-2025 il 31 gennaio 2025