Veuillez saisir au moins 3 caractères pour votre recherche.
Riepilogo
Neisseria Meningitidis GPE B Proteina di fusione ricombinante NHBA
Neisseria Meningitidis GPE B Proteina ricombinante NADA
Neisseria meningite GPE B Proteina di fusione ricombinante FHBP
CIP: 3400926863036
Metodi di riforma: Prima di aprire: 2 ° <8 ° per 4 anni (Keep in the Shelter of Light, Keep nella sua confezione, Keep in Frigratore, non congelare)
forme e presentazioni |
Composizione |
| per dose (0,5 ml) | |||
| Proteina di fusione ricombinante NHBA MeningitidisNeisseria meningitidis Gruppo B (1) || 695 (2) (3) | 50 µg | ||
| = Proteina ricombinante NADA DE || 7 Gruppo BNeisseria meningitidis groupe B (1) || 707 (2) (3) | 50 µg | ||
| = reset Fusion Protein FHBP DE meningite Neisseria groupe B (1) || 719 (2)(3) | 50 µg | ||
| Vésicules di membrana esterna (OMV) di Neisseria Meningitidis groupe B, souche NZ98/254 mesurée en tant que proportion de l'ensemble des protéines contenant l'antigène PorA P1.4(2) | 25 µg | ||
Indicazioni |
Dosaggio e modalità di amministrazione |
Connettiti pour accéder à ce contenu
Contraindicazioni |
Connect per accedere a questo contenuto
modi e precauzioni per l'uso |
Traceability: Al fine di migliorare la tracciabilità dei farmaci biologici, il nome e il numero batch devono essere chiaramente salvati.
Per quanto riguarda altri vaccini, la somministrazione di Bexsero deve essere rinviata in soggetti con una malattia febbrile febbrile acuta. Tuttavia, la presenza di un'infezione minore, come un raffreddore, non deve portare al rinvio della vaccinazione.
non iniettare per via intravascolare.
Comme pour tout vaccin injectable, un traitement médical approprié et une surveillance adéquate doivent toujours être disponibles en cas de réaction anaphylactique consécutive à l'administration du vaccin.
Reazioni correlate all'ansia, comprese le reazioni vaso-vagali (sincope), l'iperventilazione o le reazioni relative allo stress possono verificarsi durante la vaccinazione come reazione psicogena all'iniezione con un ago ( Effetti indesiderati). Il est important que des mesures soient mises en place afin d'éviter toute blessure en cas d'évanouissement.
Questo vaccino non deve essere somministrato a pazienti con trombocitopenia o qualsiasi altro disturbo di coagulazione che sarebbe una controindicazione a un'iniezione intramuscolare, a meno che il potenziale beneficio non sia chiaramente superiore ai rischi inerenti alla somministrazione. Il vaccino, la vaccinazione di BEXSerto potrebbe non proteggere tutti i soggetti vaccinati. Non si prevede che Bexsero fornisca protezione contro tutti i ceppi di Meningococcus B in circolazione (
Comme tout vaccin, la vaccination par Bexsero peut ne pas protéger tous les sujets vaccinés. Il n'est pas attendu que Bexsero assure une protection contre la totalité des souches de méningocoque B en circulation ( CF Farmacodinamica).
Per quanto riguarda molti vaccini, gli operatori sanitari devono sapere che può verificarsi un'elevazione della temperatura corporea seguendo la vaccinazione di neonati e bambini (meno di 2 anni). La somministrazione di antipiretici su base profilattica durante e subito dopo la vaccinazione può ridurre l'incidenza e la gravità delle reazioni febbri postvaccinali. Un trattamento antipiretico deve essere implementato in conformità con le raccomandazioni locali in neonati e bambini (di età inferiore ai 2 anni).
Le persone la cui risposta immunitaria è alterata o prendendo un trattamento immunosoppressivo, l'anomalia genetica o con altre cause, possono avere una risposta in anticorpo ridotto dopo la vaccinazione. I dati sull'immunogenicità sono disponibili in pazienti con un deficit di supplemento, Asplénie o una disfunzione splenica ( CF Farmacodinamica).
Les personnes ayant des déficits héréditaires du complément (par exemple les déficits en C3 ou C5) et les personnes recevant un traitement inhibiteur de l'activation de la fraction terminale du complément (par exemple, l'éculizumab) ont un risque accru de maladie invasive due à Neisseria Meningitidis del gruppo B, anche dopo aver sviluppato anticorpi dopo la vaccinazione da parte di BEXSerto.
Non ci sono dati sull'uso di BEXSerto in soggetti per oltre 50 anni e ci sono dati limitati in pazienti con malattie croniche.
Le risque potentiel d'apnée et la nécessité d'une surveillance respiratoire pendant 48 à 72 heures doivent soigneusement être pris en compte lors de l'administration des doses de primovaccination chez des grands prématurés (nés à 28 semaines de grossesse ou moins), en particulier chez ceux ayant des antécédents d'immaturité respiratoire. En raison du bénéfice élevé de la vaccination chez ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
Kanamicina viene utilizzato all'inizio del processo di produzione e viene eliminato durante le successive fasi della produzione. I livelli di kanamicina probabilmente rilevabili nel vaccino finale sono inferiori a 0,01 µg per dose.
L'innocente di Bexsero in soggetti sensibili alla kanamicina non è stato stabilito.
Questo farmaco contiene meno di 1 mmol (23 mg) di sodio per dose, cioè sodio ».
interazioni |
Connettiti per accedere a questo contenuto
Fertilità/gravidanza/allattamento |
= I dati clinici disponibili sulle gravidanze esposte al vaccino sono insufficienti. | La gravidanza è sconosciuta. Tuttavia, la vaccinazione non dovrebbe essere esclusa in presenza di un manifesto rischio di esposizione a un'infezione meningococcica.
Le risque potentiel pour les femmes enceintes est inconnu. Néanmoins, la vaccination ne doit pas être écartée en présence d'un risque manifeste d'exposition à une infection méningococcique.
Une étude au cours de laquelle des lapines ont reçu une dose de Bexsero environ 10 fois plus élevée que la dose humaine équivalente rapportée à la masse corporelle n'a montré aucun signe de toxicité maternelle ou fœtale et aucun effet sur la grossesse, le comportement maternel, la fécondité de la femelle ni sur le développement postnatal.
Nessuna informazione è disponibile sulla sicurezza del vaccino nelle donne e suo figlio durante l'allattamento. Il rapporto profitti/rischio deve essere esaminato prima di prendere la decisione di vaccinare durante l'allattamento al seno.
Nessuna reazione avversa è stata rilevata nei conigli vaccinati nella gestazione o nei loro discendenti fino a 29 E= dell'allattamento al seno. Bexsero era immunogenico negli animali nella gestazione vaccinata prima dell'allattamento al seno e gli anticorpi sono stati rilevati nei loro discendenti, sebbene i livelli di anticorpi nel latte non siano stati determinati.
Fertilità:Non ci sono dati sulla fertilità nell'uomo. | stato notato negli studi condotti negli animali.
Aucun effet sur la fertilité des femelles n'a été constaté dans les études effectuées chez l'animal.
guida e utilizzo di macchine |
Effetti indesiderati |
Connettiti per accedere a questo contenuto
Overdosage |
L'esperienza relativa al sovradosaggio è limitata. In caso di sovradosaggio, si raccomandano il controllo delle funzioni vitali e un possibile trattamento sintomatico.
Farmacodinamica |
Connettiti per accedere a questo contenuto
sicurezza preclina |
= I dati non clinici derivanti da studi tossicologici nella somministrazione ripetuta, le funzioni di riproduzione e lo sviluppo non hanno rivelato alcun rischio particolare per l'uomo.
incompatibilità |
In assenza di studi di compatibilità, questo medicinale non deve essere miscelato con altri farmaci.
ordini di consenso |
A conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler. A conserver dans l'emballage d'origine à l'abri de la lumière.
manipolazione/eliminazione modale |
Durante la conservazione, si può osservare un leggero deposito biancastro nella siringa pre -riempita contenente la sospensione.
prima dell'uso, la siringa pre -riempita deve essere ben agitata per ottenere una sospensione omogenea.
Le vaccin doit être inspecté visuellement pour mettre en évidence la présence de particules et un changement de coloration avant administration. En présence de particules étrangères et/ou d'un changement de l'aspect physique, ne pas administrer le vaccin. Si l'emballage contient deux aiguilles de longueur différente, choisir l'aiguille adéquate qui permettra une administration en intramusculaire.
Istruzioni per l'utilizzo della siringa pre -riempita
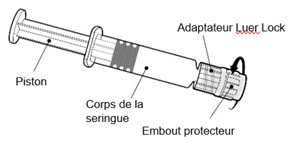 |
Prendi la siringa dal corpo della siringa e non dal pistone.
= di un orologio.
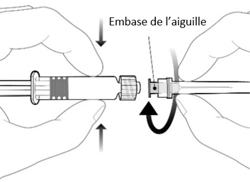 |
Pour fixer l'aiguille, connecter l'embase de l'aiguille sur l'adaptateur Luer Lock et tourner d'un quart de tour dans le sens des aiguilles d'une montre jusqu'à sentir un blocage.
non tira il pistone fuori dal corpo della siringa. Se ciò accade, non somministrare il vaccino.
Istruzioni di eliminazione
Qualsiasi farmaco non utilizzato o i rifiuti devono essere eliminati in conformità con i regolamenti in vigore.
= Prescrizione/Consegna/Supporto |
| AMM | EU/1/12/812/001; CIP 3400926863036 (RCP Rev 04.10.2023). |
| Prezzo: | 83,70 euro (scatola di 1 siringa). |
| = RECT sec 65% e indicazioni approvate: | |
|
|
| Questa categoria viene aggiunta alle altre popolazioni raccomandate da HAS il 3 giugno 2021 e il 7 marzo 2024 e richiamata di seguito: | |
| 1) Tutti i bambini di 2 mesi e prima dell'età di 2 anni. Per i bambini la cui vaccinazione è stata iniziata prima dei 2 anni, anche il richiamo fatto dopo il secondo anno è stato supportato. | |
2) persone ad alto rischio di contrarre un IIM:
|
|
| 3) Populations ciblées dans le cadre de situations spécifiques (grappes de cas, situations épidémiques, situations d'hyperendémie). | |
= di informazioni dettagliate su questo farmaco sono disponibili sul sito web dell'Agenzia europea dei medicinali (EMA): https: //www.ema.europa.eu. A
Titulaire de l'AMM : VACCINI GSK S.R.L, via Fiorentina 1, 53100 Siena, Italia.
Meningococcus B: estensione del rimborso di Bexserto agli adolescenti e ai giovani adulti
Campagna di vaccinazione contro il meningococcica B in Bretagna: perché, per chi, come?