Inserisci almeno 3 caratteri per la tua ricerca.
- droghe
- Atectura Breezhaler
- = Atectura Breezhal 125 µg/260 µg gel
Riepilogo
enveloppe de la gélule : gelatina
Inchiostro stampa: Shellac,= Ossido nero, propyneneglycol, idrossido di ammonio
een senza soglia di dose:lactose monohydrate
CIP: 3400930207796
= (Tieni lontano dalla luce, mantieni la sua confezione, tieni il passo dall'umidità)
CIP: 3400930207789
Metodi di conservazione: prima di aprire: <30 ° per 36 mesi (mantieni il riparo della luce, mantieni la confezione, tieni il passo dal riparo dall'umidità)
forme e presentazioni |
atectura breezhaler 125 microgrammi/62,5 microgrammi in polvere per inalazione nelle capsule
= Polvere per inalazione (bianco) in capsula (trasparente, trasportando il codice del prodotto "IM150-80" stampato in blu sopra di una linea blu sul corpo della capsula e il logo del prodotto stampato in blu e circondato da due linee blu sul cappuccio).
= scatola di 30 x 1 capsule, sotto piastrine unitarie predevilute di 10, con 1 inalatore.
= 10 x 1 capsule, sotto una piastra pre -accoppiata unica, con 1 inalatore (modello Hospitalle).
atectura breezhaler 125 microgrammi/127,5 microgrammi in polvere per inalazione in capsule
polvere per inalazione (bianco) in capsula (trasparente, trasportando il codice del prodotto "IM150-160" stampato in grigio sul corpo della capsula e il logo del prodotto stampato in grigio su grigio Cheffe).
Box di 30 x 1 capsule, sotto piastrine unità pre -taglio di 10, con 1 inalatore.
Boîte de 10 x 1 gélules, sous plaquette prédécoupée unitaire, avec 1 inhalateur (modèle hospitalier).
= Atectura Breezhaler 125 Microgram/260 Capsule
polvere per inalazione (bianco) in capsula (trasparente, con il codice del prodotto "IM150-320" stampato in nero sopra due linee nere sul corpo della capsula e il logo del prodotto stampato in nero e circondato da due linee nere sul cappuccio).
10 x 1 capsule, sotto i pad predeal 1 inalatore.
10 x 1 capsule, sotto una piastra pre -accoppiata dell'unità, con 1 inalatore (modello ospedaliero).
Composizione |
atectura breezhaler 125 microgrammi/62,5 microgrammi in polvere per inalazione in capsule
Chaque gélule contient 150 mcg d'indacatérol (sous forme d'acétate) et 80 mcg de furoate de mométasone.
Chaque dose délivrée à la sortie de l'embout buccal de l'inhalateur contient 125 mcg d'indacatérol (sous forme d'acétate) et 62,5 mcg de furoate de mométasone.
Atectura Breezhaler 125 microgrammes/127,5 microgrammes poudre pour inhalation en gélules
Chaque gélule contient 150 mcg d'indacatérol (sous forme d'acétate) et 160 mcg de furoate de mométasone.
Chaque dose délivrée à la sortie de l'embout buccal de l'inhalateur contient 125 mcg d'indacatérol (sous forme d'acétate) et 127,5 mcg de furoate de mométasone.
atectura breezhaler 125 microgrammi/260 microgrammi in polvere per inalazione in capsule
= Ogni capsula contiene 150 mcg di indipendenza (sotto forma di acetato) e 320 mcg di mumétasone furoato.
Chaque dose délivrée à la sortie de l'embout buccal de l'inhalateur contient 125 mcg d'indacatérol (sous forme d'acétate) et 260 mcg de furoate de mométasone.
Excipient à effet notoire :
Chaque gélule contient environ 24 mg de lactose (monohydraté).
Contenuto della capsula: lattosio monoidrato.
= Inviluppo della capsula: gelatina.
Breezhaler 125 microgrammi/62,5 microgrammi in polvere per inalazione in capsule:
Atectura Breezhaler 125 microgrammes/62,5 microgrammes poudre pour inhalation en gélules : Shellac, Brilliant Blue FCF (E133), propilen glicole (E1520), biossido di titanio (E171), ossido di ferro nero (E172).
= Atectura Breezhaler 125 microgrammi/127,5 microgrammi in polvere per inalazione in CAP: | Diossido di titanio (E171), ossido di ferro nero (E172), glicole propilenico (E1520), ossido di ferro giallo (E172), idrossido di ammonio (E527). shellac, dioxyde de titane (E171), oxyde de fer noir (E172), propylène glycol (E1520), oxyde de fer jaune (E172), hydroxyde d'ammonium (E527).
atectura breezhaler 125 microgrammi/260 polvere in polvere per inalazione: | S s Hellac, ossido di ferro nero (E172), glicole propilenico (E1520), idrossido di ammonio (E527).
Indicazioni |
Atectura Breezhaler è indicato nel trattamento continuo dell'asma negli adulti e negli adolescenti di età compresa tra 12 anni e più insufficientemente controllato da un corticosteroide inalato e una beta-2-agonista di breve durata di azione non vasta.
dosaggio e modalità di amministrazione |
Connettiti per accedere a questo contenuto
Contraindicazioni |
Connect per accedere a questo contenuto
Avvertimenti e precauzioni per l'uso |
aggravamento della malattia
Ce médicament ne devrait pas être utilisé pour le traitement des symptômes aigus de l'asthme, y compris les épisodes aigus de bronchospasme. Dans ces situations il convient d'avoir recours à un bronchodilatateur de courte durée d'action. Une augmentation de la consommation de bronchodilatateurs de courte durée d'action pour soulager les symptômes indique une détérioration du contrôle de l'asthme et les patients doivent consulter un médecin.
I pazienti non devono interrompere il trattamento senza richiedere il consiglio di un medico, i sintomi potrebbero riapparire quando si smette il trattamento. | medicinale. Se i pazienti non sentono un'efficacia del loro trattamento, non dovrebbero interromperlo ma consultare un medico. L'aumento del consumo di broncodilatatori di salvataggio indica un aggravamento dell'asma che giustifica una rivalutazione del trattamento. Un deterioramento improvviso e progressivo dei sintomi dell'asma può potenzialmente iniziare la prognosi vitale e richiedere una consulenza medica di emergenza.
Il est recommandé de ne pas arrêter brutalement le traitement par ce médicament. Si les patients ne ressentent pas une efficacité de leur traitement, ils ne doivent pas l'interrompre mais consulter un médecin. L'augmentation de la consommation de bronchodilatateurs de secours indique une aggravation de l'asthme qui justifie une réévaluation du traitement. Une détérioration soudaine et progressive des symptômes de l'asthme peut potentiellement engager le pronostic vital et nécessiter une consultation médicale en urgence.
Ipersensibilità
sono state osservate reazioni immediate dell'ipersensibilità dopo la somministrazione di questo farmaco. In caso di comparsa di segni evocativi di reazioni allergiche, in particolare un angiœdema (comprese le difficoltà respiratorie, i disturbi della deglutizione, il gonfiore del linguaggio, le labbra e le viso), gli orticini o l'eruzione cutanea, è necessario fermare un trattamento alternativo.
Bronchospasme paradoxal
Come per qualsiasi farmaco somministrato per via inalata, la somministrazione di questo farmaco può portare a un broncospasmo paradossale che può iniziare la prognosi vitale. In caso di broncospasmo paradossale, il trattamento deve essere immediatamente interrotto e deve essere stabilito un trattamento alternativo.
Effetti cardiovascolari dei beta-agonisti
Come altri farmaci contenenti agonisti beta-2-adrenergici, questo farmaco può indurre in alcuni pazienti significativi, con conseguente aumento della frequenza cardiaca, della pressione arteriosa e/o dei sintomi. Se si verificano tali effetti, potrebbe essere necessario interrompere il trattamento.
Questo farmaco dovrebbe essere usato con cautela nei pazienti con condizioni cardiovascolari (coronaropatia, infarto miocardico acuto, aritmie cardiache, ipertensione), storia di convulsione o tireotossicosi e nei pazienti con idiosincratico a beta-2-agonisti.
Les patients ayant un angor instable, un antécédent d'infarctus du myocarde au cours des 12 derniers mois, une insuffisance ventriculaire gauche de classe NYHA III/IV (New York Heart Association), une arythmie, une hypertension non contrôlée, une maladie cérébrovasculaire ou un antécédent de syndrome du QT long et les patients traités par des médicaments connus pour allonger l'intervalle QTc ont été exclus des études du programme de développement clinique d'indacatérol/furoate de mométasone. Par conséquent, les données en matière de sécurité d'emploi dans ces populations sont considérées comme inconnues.
Si des modifications de l'électrocardiogramme (ECG) telles qu'un aplatissement de l'onde T, un allongement de l'intervalle QT et un sous-décalage du segment ST ont été rapportées avec les bêta-2-agonistes, la pertinence clinique de ces observations est inconnue.
Les bêta 2 agonistes de longue durée d'action (LABA) ou les associations de substances actives contenant des LABA telles que Atectura Breezhaler doivent par conséquent être utilisés avec prudence chez les patients dont l'allongement de l'intervalle QT est connu ou suspecté ou chez les patients traités par des médicaments ayant un effet sur l'intervalle QT.
Iponokalemia con beta-agonisti
Les bêta-2-agonistes peuvent induire chez certains patients une hypokaliémie significative, pouvant entraîner des effets indésirables cardiovasculaires. La diminution de la kaliémie est généralement transitoire et ne nécessite pas de supplémentation. Chez les patients présentant un asthme sévère, les effets hypokaliémiants peuvent être potentialisés par l'hypoxie et par des traitements concomitants, ce qui peut accroître la prédisposition au risque d'arythmies cardiaques (voir rubrique interazioni). L'ipokalemia non è stata osservata negli studi clinici sull'inadaterolo/Mometasone furoato alla dose terapeutica raccomandata.
Aucun cas cliniquement pertinent d'hypokaliémie n'a été observé dans les études cliniques de l'indacatérol/furoate de mométasone à la dose thérapeutique recommandée.
iperglicemia
L'inalazione di alte dosi di beta-2-agonisti e corticosteroidi può indurre aumenti di zucchero nel sangue. La glicemia deve essere monitorata più da vicino nei pazienti diabetici non appena viene stabilito il trattamento.
Questo farmaco non è stato studiato in pazienti con diabete di tipo I o diabete di tipo II insufficientemente controllato.
= Prevenzione delle infezioni orofaringee
Afin de réduire le risque d'infection oropharyngée à candida, il faut recommander aux patients de se rincer la bouche ou de se gargariser avec de l'eau sans l'avaler ou de se brosser les dents après l'inhalation de chaque dose.
Effetti sistemici collegati alla terapia corticosteroide
Gli effetti sistemici legati ai corticosteroidi inalati possono verificarsi, in particolare durante i periodi a lungo termine. Questi effetti hanno molto meno probabilità che si verifichino rispetto alla terapia corticosteroide orale e gli effetti possono variare da un paziente all'altro e secondo le diverse preparazioni di corticosteroidi.
= I possibili effetti sistemici possono includere una sindrome di Cushing, manifestazioni di cushingoidi, un'inibizione della funzione surrenale, un ritardo della crescita nei bambini e adolescenti, una diminuzione della densità minerale ossea, della cataratta, del glaratta e del glaucoma e più raramente, una serie di disturbi psicologici o comportamentali, tra cui disturbi psicomotori, disordini per il sonno, ansia o aggressione bambini). È quindi importante che la dose di corticosteroidi inalati sia regolata alla dose più bassa con cui viene mantenuto un controllo efficace dell'asma.
Disturbi visivi possono essere riportati con l'uso di corticosteroidi sistemici e topici (inclusi intranasali, inalati e intraoculari). I pazienti con sintomi come una visione travagliata o altri disturbi visivi, devono essere orientati verso un oftalmologo per una valutazione delle possibili cause dei disturbi visivi, che possono includere cataratta, glaucoma o malattie rare come la coritinopatia sereosa centrale (CSCR) che è stata riportata dopo l'uso di corticosterie sistemiche e topico.
Questo farmaco deve essere somministrato con cautela nei pazienti con tubercolosi polmonare o in pazienti con infezioni croniche o non realizzate.
EXPIPIENTS
Questo farmaco contiene lattosio. I pazienti con intolleranza al galattosio, deficit di lattasi totale o sindrome da malassorbimento di glucosio e galattosio (malattie ereditarie rare) non dovrebbero assumere questo medicinale.
interazioni |
Connect per accedere a questo contenuto
Fertilità/gravidanza/allattamento |
gravidanza
I dati relativi all'uso di atectura breezhaler o dei suoi singoli componenti (indicaterolo e mumétasone furoate) nelle donne in gravidanza non sono sufficienti per determinare se esiste un rischio.
L'Idacaterolo non è stato teratogenico nei ratti e nel coniglio dopo il percorso sottocutaneo (vedere Sezione || PreclinicaSécurité préclinique). Negli studi di riproduzione su topi, ratti e conigli incinti, il mometasone furoato ha aumentato le malformazioni fetali e ridotto la sopravvivenza e la crescita del feto.
Come gli altri farmaci contenenti agonisti che aggiungono beta-2, l'inacaterolo può inibire il lavoro al momento del muscolo uterino liscio.
Questo farmaco dovrebbe essere utilizzato durante la gravidanza solo se il beneficio atteso per il paziente giustifica il potenziale rischio per il feto.
allattamento al seno
Il n'existe pas de données disponibles sur la présence de l'indacatérol ou du furoate de mométasone dans le lait maternel, ni sur les effets sur le nourrisson allaité ou les effets sur la production de lait. D'autres corticoïdes inhalés similaires au furoate de mométasone passent dans le lait maternel. L'indacatérol (y compris ses métabolites) et le furoate de mométasone ont été détectés dans le lait de rates allaitantes.
Una decisione deve essere presa per interrompere l'allattamento al seno o per interrompere/astenersi dal trattamento tenendo conto del beneficio dell'allattamento al seno per il bambino per quanto riguarda il beneficio del trattamento per la donna.
Fertilità
Gli studi riproduttivi e gli altri dati negli animali non indicano alcun effetto avverso sulla fertilità nei maschi o nelle femmine.
Guida e utilizzo di macchine |
Ce médicament n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
Effetti indesiderati |
Connettiti per accedere a questo contenuto
ourdosage |
Si raccomandano una sorveglianza e un trattamento sintomatico in caso di sovradosaggio. | Associato all'attività farmacodinamica dei singoli componenti (ad esempio, tachicardia, tremori, palpitazioni, mal di testa, nausea, vomito, sonnolenza, aritmia ventricolare, acidosi metabolica, ipokalemia, iperglicemia, inibizione dell'asse ipotalamo-emepo-urelenis).
Un surdosage devrait probablement conduire à des signes, symptômes ou effets indésirables associés à l'activité pharmacodynamique des composants individuels (par exemple, tachycardie, tremblements, palpitations, céphalées, nausées, vomissements, somnolence, arythmies ventriculaires, acidose métabolique, hypokaliémie, hyperglycémie, inhibition de l'axe hypothalamo-hypophyso-surrénalien).
L'uso di beta-bloccanti cardioselettivi può essere considerato per trattare gli effetti beta-2-adrenergici, ma solo sotto la sorveglianza di un medico e con estrema cautela perché la somministrazione di beta-bloccanti può indurre un broncospasmo. In casi gravi, i pazienti devono essere ricoverati in ospedale.
Farmacodinamica |
Connettiti per accedere a questo contenuto
Pharmacokinetics |
Connettiti per accedere a questo contenuto
Preclinical |
Associazione di INDACATEROL e MEMETASONE FUROATE
Le osservazioni fatte durante gli studi di tossicità da 13 settimane per via inalati sono principalmente attribuibili al componente feroato di Mometasone e corrispondono agli effetti farmacologici caratteristici dei glucocorticoidi. Gli aumenti della frequenza cardiaca associati all'inacaterolo sono stati osservati nei cani dopo la somministrazione di indicaterolo/mometasone solaoato o indecaterolo da solo.
INDACATEROL
Nei cani, gli effetti sul sistema cardiovascolare attribuibili ai beta-2-agonisti indicaterolo erano tachicardia, aritmia e lesioni miocardiche. Una leggera irritazione della cavità nasale e della laringe è stata osservata nei roditori.
Gli studi di genotossicità non hanno rivelato un potenziale mutageno o clastogenico.
La carcinogenicità è stata valutata in uno studio di due anni nel ratto e in uno studio di sei mesi in un topo transgenico. Le maggiori implicazioni dei leiomiomi ovarici benigni e l'iperplasia focale del muscolo ovaio liscio nella femmina mancante con le osservazioni simili riportate per altri agonisti di adrenergici beta-2. Non è stato osservato alcun segno di cancerogenicità nei topi.
Tutti questi effetti si sono verificati in mostre molto più alte di quelle previste nell'uomo.
Après administration sous-cutanée dans une étude chez le lapin, les effets indésirables de l'indacatérol sur la grossesse et le développement embryo-fœtal n'ont été observés qu'à des doses plus de 500 fois supérieures à celles obtenues après l'inhalation quotidienne de 150 mcg chez l'homme (sur la base de l'ASC0-24 h).
Sebbene l'indacaterolo non abbia influenzato le funzioni di riproduzione generale in uno studio di fertilità nei ratti, durante uno studio è stata osservata una diminuzione del numero di gravidi di femmine di ratto alla generazione di F1. L'inadaterolo non è stato embriotossico o teratogenico nel ratto o nel coniglio.
Mometasone furoate
Tutti gli effetti osservati sono caratteristici della classe di glucocorticoidi e corrispondono a un'esacerbazione degli effetti farmacologici dei glucocorticoidi. | De Mometasone non ha mostrato alcuna attività genotossica in una batteria di prova standard
Le furoate de mométasone n'a pas montré d'activité génotoxique dans une batterie standard de tests in vitro e in vivo.
In studi di cancerogenicità su topi e ratto, mumeta di aumento statisticamente significativo dell'incidenza dei tumori.
Comme les autres glucocorticoïdes, le furoate de mométasone est tératogène chez les rongeurs et les lapins. Les effets observés ont été l'apparition de hernies ombilicales chez le rat, de fentes palatines chez la souris et d'agénésies de la vésicule biliaire, de hernies ombilicales et de flexions des pattes avant chez le lapin. Il a également été observé une baisse de la prise de poids chez les mères, des effets sur la croissance fœtale (poids fœtal plus faible et/ou retard d'ossification) chez le rat, le lapin et la souris, de même qu'une diminution de la survie de la progéniture chez la souris. Dans les études sur la fonction de reproduction, l'injection sous-cutanée de furoate de mométasone, à la dose de 15 mcg/kg, a entraîné un allongement de la gestation ainsi qu'un accouchement difficile avec une réduction de la survie et du poids de la progéniture.
Valutazione del rischio ambientale
Des études d'évaluation du risque environnemental ont montré que la mométasone peut présenter un risque pour les eaux de surface (voir rubrique Eliminazione/Manipolazione).
DEVAZIONE ORDINE |
3 anni.
su precauzioni speciali di conservazione |
30 ° C.
da conservare nella confezione originale riparata dalla luce e dall'umidità.
Precauzioni particolari per l'eliminazione e la manipolazione |
Dovrebbe essere usato l'inalatore fornito con ogni nuova prescrizione. L'inalatore incluso in ogni scatola deve essere eliminato dopo che tutte le capsule di questa scatola sono state utilizzate.
Questo farmaco può presentare un rischio per l'ambiente (vedere la sezione sicurezza preclinica).
Tutti i farmaci o i rifiuti non utilizzati devono essere eliminati in conformità con la regolamentazione in vigore. | Usa e manipolazione
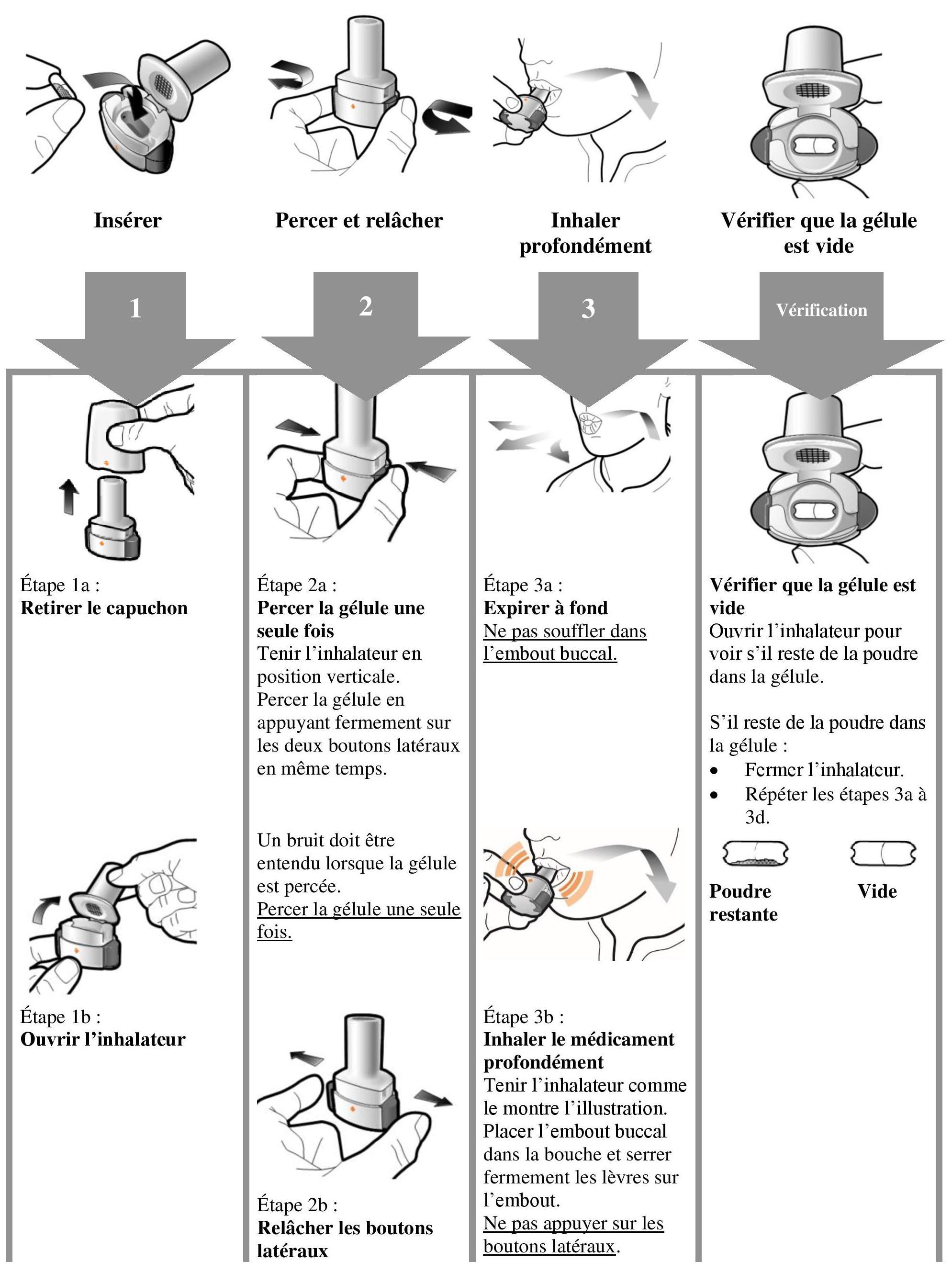
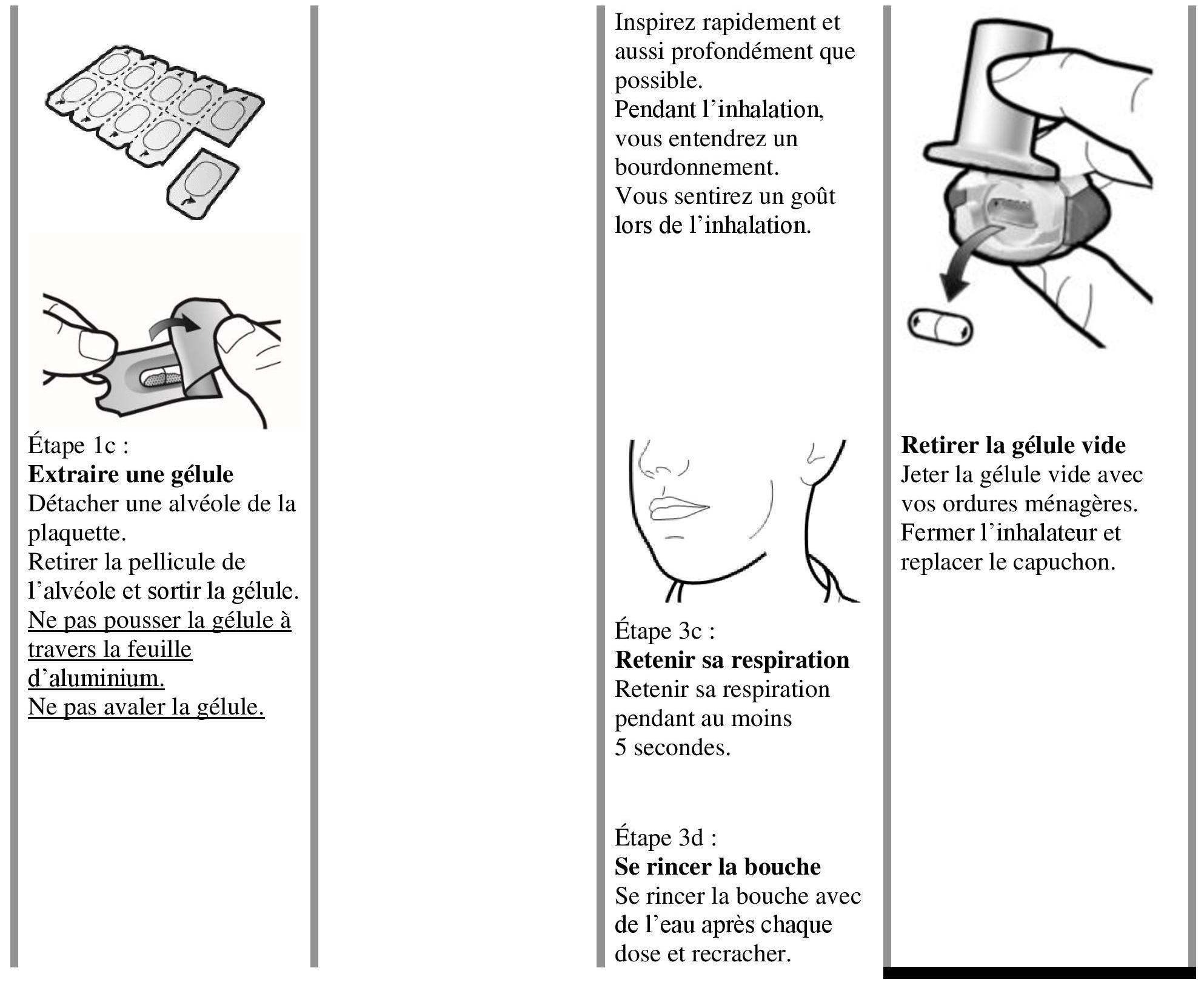
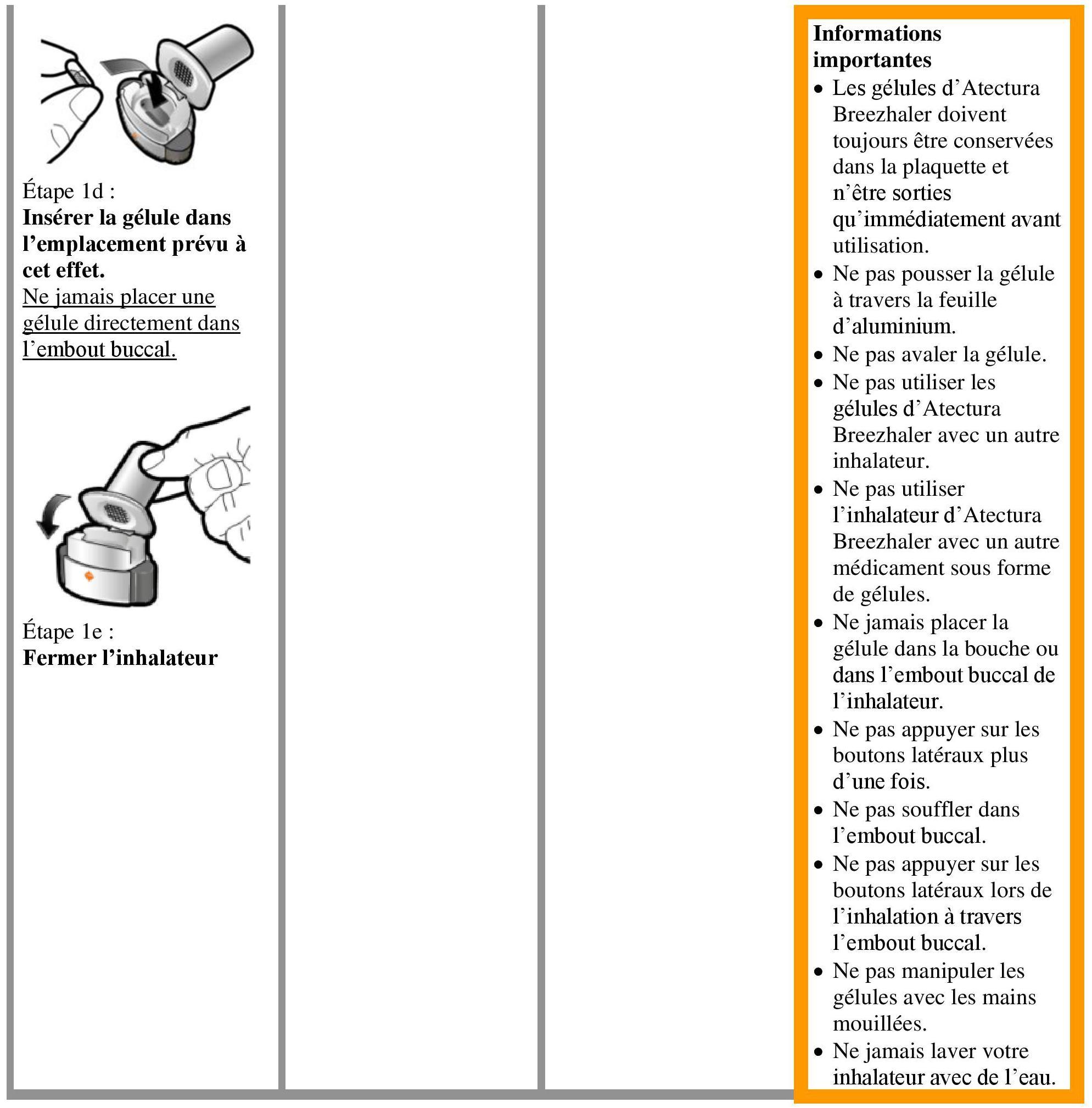
Instructions pour l'utilisation et la manipulation
Lire l'ensemble des Istruzioni per la manipolazione prima di usare Atectura Breezhaler.

prescrizione/consegna/sviluppo |
| AMM |
|
| Prezzo: |
|
| AMM |
|
| Prezzo: |
|
| AMM |
|
| Prezzo: |
|
REMB SEC SOC al 65%. Raccogliere.
Modello ospedaliero: raccolta.
Des informations détaillées sur ce médicament sont disponibles sur le site internet de l'Agence européenne des médicaments : https: //www.ema.europa.eu. | AMM:
Titulaire de l'AMM : Novartis European Limited, Vista Building, Elm Park, Merrion Road, Dublino 4, Iland.
 = Documento utile Vidal
= Documento utile Vidal