| polvere: | by bottiglia |
AltePlase* (DCI)
| 10 mg (5.8 MUI) |
| o | (11.6 MUI) | 20 mg (11,6 MUI) |
| o | 50 mg (29 MUI) |
Eccipienti: arginina, acido fosforico (per l'adattamento del pH), polisorbato 80.
Solvant:eau pour préparations injectables.
* L'alteplase è prodotta dalla tecnica del DNA ricombinante in una linea di ovaio cellulare di criceto cinese.
L'attività specifica della sostanza di riferimento interna è 580.000 UI/mg, questo valore è confermato dal confronto con il secondo standard internazionale. La specifica per l'attività specifica dell'alteplase va da 522.000 a 696.000 UI/mg.
-
Trattamento trombolitico alla fase acuta dell'infarto del miocardio:
-
- = Diagramma terapeutico chiamato "accelerato" (90 minuti) (|| somministrazionecf Posologie et Mode d'administration): destinato ai pazienti in cui il trattamento può essere iniziato entro 6 ore dalla comparsa dei sintomi.
- = Diagramma violento chiamato "3 ore" ( DOSAGGIO CF e modalità di somministrazione): destinato ai pazienti in cui il trattamento può essere avviato tra 6 e 12 ore dopo i sintomi, a condizione che l'indicazione sia evidente.
- L'alteplase riduce il tasso di mortalità a 30 giorni dopo l'infarto del miocardio.
-
Trattamento trombolitico dopo embolia polmonare massiccia nella fase acuta con instabilità emodinamica:
- La diagnosi deve essere confermata, per quanto possibile, con metodi oggettivi (angiografia, scanner).
- Non vi è alcuna prova di un profitto in termini di mortalità morbica in questa indicazione. Fibrinolitico dell'ictus ischemico nella fase acuta:
-
Traitement fibrinolytique de l'accident vasculaire cérébral ischémique à la phase aiguë :
- Il trattamento deve essere introdotto il più presto possibile entro il tempo delle 4:30 in seguito alla comparsa dei sintomi dell'ictus e dopo aver escluso un'emorragia intracranica mediante appropriate tecniche di imaging (ad esempio, tomodensitometria cerebrale o altro metodo di emorragia del metodo di imaging). L'effetto del trattamento dipende dal tempo; Di conseguenza, più il trattamento viene somministrato in anticipo, più è elevata la probabilità di risultato clinico favorevole.
dosaggio e modalità di amministrazione |
Connettiti per accedere a questo contenuto
Avvertimenti e precauzioni per l'uso |
Traceability: Per migliorare la tracciabilità dei farmaci biologici, il nome e il numero batch del prodotto somministrato devono essere chiaramente registrati.
La presentazione appropriata di Acttlese deve essere scelta attentamente e in conformità con l'uso pianificato. La bottiglia di 2 mg di alteplase non è adatta per l'uso nella fase acuta dell'infarto miocardico, embolia polmonare massiccia nella fase acuta o ictus ischemico (a causa di un rischio significativo di inclinazione). Per questi usi sono indicate solo le bottiglie di 10 mg, 20 mg e 50 mg.
Qualsiasi trattamento trombolitico/fibrinolitico richiede un supporto adeguato. Attualmente dovrebbe essere utilizzato solo sotto la responsabilità e il monitoraggio dei medici addestrati ed esperti nell'uso di agenti trombolitici e con mezzi di sorveglianza adeguati. Si raccomanda di amministrare aclysi all'interno di strutture che hanno permanentemente attrezzature e trattamenti.
-
Ipersensibilità:
- Le reazioni dell'ipersensibilità alla mediazione immunitaria associata alla somministrazione di Actilyse possono essere indotte dalla sostanza alteplasi attiva o da uno degli esvisori.
- Aucune formation durable d'anticorps dirigés contre la molécule recombinante d'activateur tissulaire du plasminogène humain n'a été observée après le traitement. Il n'y a pas de données relatives à une réadministration d'Actilyse.
- C'è anche un rischio di reazioni di ipersensibilità, mediate da un meccanismo non immunologico.
- La reazione di ipersensibilità più frequentemente riportata con Actilyse è l'edema di Quincke. Il rischio può essere aumentato nel caso di un ictus ischemico nella fase acuta e/o prendendo un trattamento concomitante in base all'enzima dell'enzima per la conversione dell'angiotensina ( CF Interazioni). Il rischio di edema Quincke deve essere monitorato nei pazienti trattati indipendentemente dall'indicazione autorizzata, durante l'infusione e entro 24 ore dall'infusione.
- In caso di una grave reazione di ipersensibilità (ad esempio edema di Quinck), l'infusione deve essere interrotta e un trattamento appropriato stabilito immediatamente. Ciò può includere l'intubazione.
-
Hémorrhages:
- La complicazione più frequentemente incontrata durante il trattamento con Actilyse sta sanguinando. L'uso concomitante di altre sostanze attive che agisce su coagulazione o funzione piastrinica può contribuire al sanguinamento. Durante il trattamento con Actilyse, la fibrina è lisée, che può causare sanguinamento nei siti di puntura recenti. Pertanto, qualsiasi trattamento trombolitico richiede particolare attenzione a tutti i potenziali siti di sanguinamento (compresi quelli che seguono l'inserimento di un catetere, punti arteriosi o venosi, sedili di incisione e punti di morso). L'uso di cateteri rigidi, iniezioni intramuscolari e interventi non essenziali devono essere evitati durante il trattamento con Actilyse.
- Il trattamento fibrinolitico e il trattamento concomitante con eparina devono essere immediatamente interrotti in caso di emorragia potenzialmente pericolosa, in particolare un'emorragia cerebrale. In generale, tuttavia, non è necessario somministrare i fattori di coagulazione a causa della breve emivita dell'alteplase e dei suoi bassi effetti su questi fattori di coagulazione sistemica. Nella maggior parte dei casi, il sanguinamento può essere controllato mediante interruzione di trattamenti trombolitici e anticoagulanti, mediante la somministrazione di una soluzione di riempimento vascolare o mediante pressione manuale sulla nave ferita. Possiamo prendere in considerazione l'uso della protamina in caso di somministrazione di eparina entro 4 ore precedenti il verificarsi dell'emorragia. Nei pazienti rari che non soddisfano queste misure conservative, è possibile prendere in considerazione l'uso appropriato di prodotti trasfusioni. Una trasfusione di crioprepilità, plasma o piastre fresco congelati può essere considerata monitorando i parametri clinici e organici dopo ogni somministrazione. Il tasso di fibrinogeno da raggiungere in caso di infusione crioprepipata è 1 g/L. L'anifibrinolitico costituisce l'ultima alternativa terapeutica.
- Il rischio di emorragia intracranica è aumentato negli anziani; Di conseguenza, è necessario valutare attentamente il rapporto beneficio/rischio in questo tipo di paziente.
- Per quanto riguarda tutti gli agenti trombolitici, l'uso di alteplase deve tenere attentamente i possibili rischi e il beneficio terapeutico previsto, in particolare nei seguenti casi:
- Trauma minore recente, come biopsie, grandi vasi, iniezioni intramuscolari, massaggio cardiaco durante una rianimazione.
- Patologia che probabilmente aumenterà un rischio di emorragici e non appare nella sezione Contraindicazioni.
-
-
In caso di orali di trattamento concomitanti:
- L'utilisation d'Actilyse peut être envisagée lorsque la dose ou le délai depuis la dernière prise de traitement anticoagulant rend peu probable un effet résiduel et que ceci est confirmé par un ou des test(s) approprié(s) de l'activité anticoagulante pour le(s) produit(s) concerné(s) ne montrant pas d'activité cliniquement significative sur le système de la coagulation (par exemple INR ≤ 1,3 pour les antagonistes de la vitamine K, ou si le ou les autre(s) test(s) approprié(s) pour les autres anticoagulants oraux ne dépassent pas la limite supérieure de la normale).
-
Popolazione pediatrica:
- bambini e adolescenti.
- Lorsque Actilyse est envisagé comme traitement de l'accident vasculaire cérébral ischémique à la phase aiguë chez des adolescents âgés de 16 ans ou plus, sélectionnés avec attention, le bénéfice du traitement doit être attentivement évalué de manière individuelle, par rapport aux risques encourus. Ce choix doit être discuté avec le patient et les parents ou le tuteur le cas échéant. Les adolescents âgés de 16 ans ou plus doivent être traités selon les instructions de cette monographie données pour les patients adultes, après une technique d'imagerie appropriée permettant d'exclure les pathologies mimant l'accident vasculaire cérébral et confirmant l'occlusion artérielle, correspondant au déficit neurologique ( Cf Farmacodinamica).
Mises en garde spéciales et précautions particulières d'emploi complémentaires dans les indications d'infarctus du myocarde à la phase aiguë et d'embolie pulmonaire massive à la phase aiguë :
non somministrano una dose di alteplase superiore a 100 mg, a causa dell'aumento del rischio di emorragia intracranica. | Assicurarsi che la dose di alteplase somministrata sia tale che descrive nella sezione
Des précautions particulières doivent être prises pour s'assurer que la dose d'altéplase administrée est telle que décrite dans la rubrique dosaggio e metodo di amministrazione.
L'uso di alteplase deve tenere attentamente conto dei possibili rischi e del beneficio terapeutico atteso, in particolare nei pazienti la cui pressione arteriosa sistolica è superiore a 160 mm Hg ( CF Controindications) e nelle persone di età avanzata perché ciò può aumentare il rischio di emorragia intracerebrale. Il beneficio terapeutico è ancora positivo per i pazienti anziani, una valutazione del rapporto beneficio/rischio deve essere effettuata attentamente.
antagonisti dei recettori GPIIB/IIIA: la somministrazione concomitante di un antagonista del recettore GPIIB/IIIA aumenta il rischio di emorragici. | In caso di infarto miocardico nella fase acuta:
Mises en garde spéciales et précautions particulières d'emploi en cas d'infarctus du myocarde à la phase aiguë :
-
aritmie:
- Una trombolisi coronarica può causare un'aritmia di riperfusione.
- Un'aritmia di riperfusione può causare un arresto cardiaco, coinvolgere la prognosi vitale e richiedere convenzionali l'uso di terapie antiaritmiche.
-
ThromboemBolie:
- L'uso dei trombolitici può aumentare il rischio di eventi tromboembolici in pazienti con trombo con il cuore sinistro, come una stenosi della valvola mitrale o una fibrillazione atriale. | Caso di ictus ischemico nella fase acuta:
Mises en garde spéciales et précautions particulières d'emploi complémentaires en cas d'accident vasculaire cérébral ischémique à la phase aiguë :
-
Precauzioni speciali per l'uso:
- L'introduzione e il monitoraggio del trattamento devono essere eseguiti sotto la responsabilità di un medico addestrato e sperimentato nella patologia neurovascolare. Per la verifica della scelta dell'elaborazione, le misure diagnostiche distanti (telemedicina) possono essere considerate appropriate ( CF Indicazioni). Vedi 937
-
Mises en garde spéciales/Populations ayant une diminution du rapport bénéfice/risque :
- L'emorragia intracerebrale rappresenta vascolare cerebrale ischemica nella fase acuta (fino al 15% dei pazienti senza aumento della mortalità complessiva e senza un aumento significativo del criterio combinato Mortalità complessiva combinata+handicap maggiore, vale a dire che presenta un punteggio sulla scala di Rankin modificata (MR) di 5 e 6).
- rispetto alle altre indicazioni, i pazienti trattati con uno strat ischemico strato nella fase acuta presentano un marcato aumento del rischio di emorragia intracranica, le emorragie si verificano preferibilmente nell'area dell'infarto.
- Cette mise en garde s'applique notamment aux cas suivants :
- Qualsiasi situazione menzionata nel paragrafo Contraindicazioni et, plus généralement, toute situation impliquant un risque hémorragique important.
- più il periodo di elaborazione in base alla comparsa dei sintomi dell'ictus aumenta di più, maggiore è il beneficio clinico netto diminuisce. Di conseguenza, l'amministrazione di Actilysi non dovrebbe essere ritardata.
- I pazienti che hanno precedentemente ricevuto un trattamento con acido acetilsalicilico (AAS) possono presentare un aumentato rischio di emorragia intracerebrale, in particolare se il trattamento con Actilyisi è messo in atto in ritardo.
- rispetto ai pazienti più giovani, i pazienti con più di una vecchiaia (80 anni) possono avere risultati clinici meno buoni indipendentemente dal trattamento. È anche probabile che abbiano un ictus più grave associato a un rischio assoluto di emorragia intracerebrale in caso di trattamento con trombolisi rispetto all'ictus moderato trattato mediante trombolisi o rispetto ai pazienti non trattati con trombolisi. Sebbene i dati disponibili mostrino che l'utile netto di ActilSse nei pazienti di età superiore a 80 anni è inferiore rispetto ai pazienti più giovani. Actilyse può essere utilizzato in pazienti di età superiore a 80 anni sulla base del beneficio e del rischio individuale ( CF Farmacodinamica). I pazienti con età avanzata devono essere selezionati attentamente tenendo conto sia della salute generale che dello stato neurologico.
- Il beneficio terapeutico è ridotto nei pazienti con storia di ictus (vedi anche la sezione Contraindicazioni) o presentando un diabete non controllato. In questi pazienti, il rapporto a rischio di beneficio è considerato meno favorevole, ma rimane positivo.
- Nei pazienti con una leggera forma di ictus, i rischi legati al trattamento prevalgono sul profitto atteso ( CF Contraindicazioni). Grave, presenta un maggior rischio di sanguinamento intracranico e di morte e non deve essere trattato con Actilyse.
- Les patients ayant fait un accident vasculaire cérébral très sévère, présentent un risque plus important d'hémorragie intracrânienne et de décès et ne doivent pas être traités par Actilyse.
- pazienti che hanno fatto un ampio infarto hanno un aumentato rischio di sviluppo sfavorevole (comprese emorragie gravi e di morte). Il rapporto beneficio/rischio deve essere attentamente valutato in questi pazienti.
- Nei pazienti con ictus, la probabilità di sviluppo favorevole diminuisce con l'aumento del tempo di elaborazione dalla comparsa dei sintomi, con l'età, con il grado di gravità del danno e con gli alti tassi di zucchero nel sangue, mentre il rischio di grave disabilità, morte o emorragia intracranica di morte aumenta
- Il trattamento non deve essere avviato dopo 4,5 ore dopo la comparsa dei sintomi, il bilancio beneficio/rischio diventa sfavorevole a causa:
-
- di una riduzione dell'effetto positivo del trattamento nel tempo;
- pazienti trattati in precedenza con acido acetilsalicilico;
- di un aumento del rischio di emorragie sintomatiche.
-
Allenamento della pressione sanguigna:
- Un monitoraggio della pressione sanguigna deve essere implementato durante la somministrazione del trattamento e deve essere mantenuto per 24 ore. Se la pressione arteriosa sistolica è maggiore di 180 mm Hg o se la pressione arteriosa diastolica è maggiore di 105 mm Hg, si raccomanda un trattamento antiipertensivo per via endovenosa.
-
Autres mises en garde spéciales :
- La riperfusione dell'area dell'ischemia può causare edema cerebrale nell'area dell'infarto. A causa di un aumento del rischio emorragico, non è necessario iniziare alcun trattamento anti-agurizzero entro le prime 24 ore di trattamento trombolitico da Alteplase.
Fertilità/gravidanza/allattamento |
Grossesse :
I dati sulla somministrazione di alteplase alle donne in gravidanza sono limitati. Studi non clinici condotti con alteplase a dosi più elevate rispetto a quelle utilizzate nell'uomo hanno rivelato immaturità fetale e/o embriotossicità secondaria all'attività farmacologica nota del prodotto. L'alteplase non è considerata teratogena ( CF Preclinical Security). In caso di minaccia della prognosi vitale, dobbiamo tenere conto dei benefici attesi e dei possibili rischi.
allattamento al seno:
Non sappiamo se l'alteplase è escreta nel latte umano e i dati sull'escrezione nel latte animale sono limitati.
l'allattamento al seno e una decisione riguardante l'interruzione dell'allattamento al seno durante le prime 24 ore dopo che l'uso di Aclylyisi deve essere preso.
Fertilità:
Non ci sono dati clinici sulla fertilità disponibili per Actilyse. Studi non clinici condotti con alteplase non hanno mostrato alcun effetto indesiderato sulla fertilità ( CF Preclinical Security).
Connect per accedere a questo contenuto
-
Sintomi:
- Se viene superata la dose massima raccomandata, aumenta il rischio di emorragia intracranica.
- Nonostante la specificità relativa dell'alteplase per la fibrina, un sovradosaggio può causare fibrinogeno e altri fattori di coagulazione.
-
Trattamento:
- Nella maggior parte dei casi, è sufficiente aspettare la rigenerazione fisiologica di questi elementi dopo la fine del trattamento con Aclysy.
- Tuttavia, se si verifica un'emorragia grave, si raccomanda la trasfusione di plasma fresco congelato, nonché, se necessario, la somministrazione di antifibrinolitico sintetico.
I test di tossicità subcronica nel ratto e la scimmia non hanno evidenziato un effetto inaspettato. | di potenziale mutageno.
Les tests de mutagenèse n'ont pas mis en évidence de potentiel mutagène.
Nessun effetto teratogenico è stato osservato dopo infusione endovenosa di dosi farmacologicamente attive nella femmina in gravidanza. La somministrazione di oltre 3 mg/kg/giorno ha indotto un'embritossicità (mortalità embrionale, ritardo della crescita) nel coniglio. Nessun effetto sullo sviluppo permanente e post-natale e i parametri della fertilità sono stati osservati a dosi fino a 10 mg/kg/die nei ratti.
La soluzione ricostituita può essere diluita in una soluzione sterile di cloruro di sodio allo 0,9% fino a una concentrazione minima di 0,2 mg di alteplase per ml.
In caso di una nuova diluizione, l'uso dell'acqua per i preparati iniettabili o in generale l'uso di soluzioni di glucosio per l'infusione, ad esempio destrosio, non è raccomandato a causa della maggiore formazione di torbidità nella soluzione ricostituita.
Actilyse non deve essere miscelato con altri farmaci (inclusa l'eparina), la stessa bottiglia per l'infusione o nello stesso catetere.
modalità di conservazione |
Bottiglie aperte:
Durata di lettura:
-
Actilyse 10 mg: 2 anni.
-
Actilyse 20 mg et 50 mg : 3 ans.
da tenere nella confezione originale, al riparo dalla luce.
da mantenere a una temperatura non superiore a +25 ° C.
= Soluzione ricostituita:
La stabilità della soluzione ricostituita è stata dimostrata per 24 ore tra 2 ° C e 8 ° C, 25 ° C.
Dal punto di vista microbiologico, il prodotto deve essere utilizzato immediatamente dopo la ricostruzione. In caso di utilizzo non immedio, le durate e le condizioni di conservazione dopo la ricostruzione e prima dell'uso rientrano nella sola responsabilità dell'utente e normalmente non devono superare le 24 ore tra 2 ° C e 8 ° C.
Manipolazione/eliminazione degli ufficiali |
Per ottenere una concentrazione finale di 1 mg di alteplase per ml, il volume totale di solvente. contenente la polvere Actilyse. A tale scopo viene fornita una cannula di trasferimento con presentazioni di 20 e 50 mg. Per la bottiglia da 10 mg, è necessario utilizzare una siringa.
Per ottenere una concentrazione finale di 2 mg di alteplase per ml, è necessario utilizzare solo la metà del volume di solvente fornito (vedere la tabella sotto). In questo caso, una siringa deve essere sempre utilizzata per introdurre il volume richiesto di solvente nella bottiglia contenente il liofili attivo.
Quantità di polvere Actilyse
| Quantité de poudre d'Actilyse | 10 mg | 20 mg | 50 mg |
| (a) Volume dell'acqua sterile per preparati iniettabili da aggiungere alla polvere | 10 mL | 20 ml | 50 ml |
| Concentrazione finale: | 1 mg di alteplase/ml | 1 mg di alteplase/ml | 1 mg di alteplase/ml || Per i preparati iniettabili da aggiungere alla polvere |
| (b) Volume d'eau stérile pour préparations injectables à ajouter à la poudre | 5 ml | 10 ml | 25 ml |
| Concentrazione finale: | 2 mg di alteplase/ml | 2 mg di alteplase/ml | D'ALTéplase/ML | 2 mg d'altéplase/ml |
La soluzione ricostituita deve quindi essere somministrata per via endovenosa. La soluzione ricostituita di 1 mg/mL può essere più diluita con una soluzione di iniezione sterile di cloruro di sodio a 9 mg/mL (0,9%) fino a una concentrazione minima di 0,2 mg/ml perché non può essere escluso la comparsa di torbidità nella soluzione ricostruita. Non è consigliabile diluire ulteriormente la soluzione ricostituita di 1 mg/mL mediante acqua per preparati iniettabili o un soluto dolce (destrosio, ad esempio, a causa dell'aumento dell'allenamento della torbidità nella soluzione ricostituita). AclylySis non dovrebbe essere mescolato con altri farmaci (inclusa l'eparina) nella stessa bottiglia di infusione.
per incompatibilità, CF incompatibilità.
La solution reconstituée est destinée à un usage unique. Toute solution non utilisée ou déchet doit être éliminé conformément à la réglementation en vigueur.
-
Istruzioni per la ricostruzione di ActilySis:
-
- ricostruita immediatamente prima dell'amministrazione.
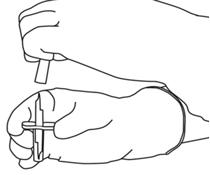
- Rimuovere il tappo protettivo delle due bottiglie contenenti l'acqua per preparati iniettabili e la polvere di Actilyse, sollevando i Capuchon con il pollice.
- Pulisci la parte superiore della gomma di ogni bottiglia usando un tampone imbevuto di alcol.
- Prendi la cannula di trasferimento* del suo caso. Non disinfettare o non sterilizzare la cannula di trasferimento, è sterile. Rimuovi uno dei suoi cappelli.
*
(Se una cannula di trasferimento è inclusa nella scatola. La ricostruzione può anche essere fatta con una siringa e un ago.)
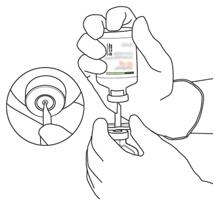
- Tenere la bottiglia contenente l'acqua per preparati iniettabili in posizione verticale e su una superficie stabile. Sulla parte superiore della bottiglia, perforare il tappo di gomma con la cannula di trasferimento, verticalmente e bene al centro della spina, premendo lentamente ma saldamente, senza girare.
- Tenere saldamente la bottiglia contenente l'acqua per i preparati iniettabili e la cannula di trasferimento con una mano, usando i due alette su ciascun lato del cannule. | Capuchon rimane sulla parte superiore della cannula di trasferimento.
Retirez le capuchon restant sur le dessus de la canule de transfert.
- = Tenere fermamente la bottiglia contenente l'acqua per i preparati di iniezione e la cannula di trasferimento con una mano, usando i due alette su ciascun lato della cannula.
Prendi la bottiglia di attilesi contenente la polvere e tienila verticalmente sopra la molla del corno di trasferimento della cannula di trasferimento al centro della spina.
proprio verticalmente la bottiglia contenente la polvere sulla cannula di trasferimento, delicatamente ma saldamente e senza girare, fino alla perforazione del cappuccio della spina.
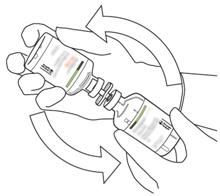
- Restituisci le due bottiglie in modo che l'acqua per i preparati iniettabili possa riempire completamente la bottiglia contenente la bottiglia contenente la polvere di bottiglia.
- Rimuovere la bottiglia vuota che conteneva l'acqua per i preparati iniettabili contemporaneamente alla cannula di trasferimento.
Ils peuvent être jetés.
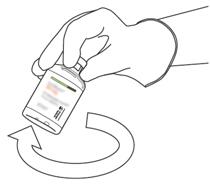
- Prendi la bottiglia contenente la soluzione ricostituita di Actilyse e delicatamente l'agite fino a quando non si dissolve tutto rimane di polvere, ma non per mescolare, che non si muoverà, che non si muoverà, che mousserà.
Se ci sono bolle, lascia riposare la soluzione per alcuni minuti e attendere la scomparsa delle bolle.
- La soluzione ricostituita rappresenta 1 mg/ml di alteplase. Deve essere chiaro e incolore, anche giallo pallido e non deve contenere particelle.
- Prendi la quantità richiesta solo da un ago e una siringa.
Non utilizzare lo stesso foro di perforazione di quello della cannula di trasferimento per evitare qualsiasi perdita.
- usa immediatamente. | non usato.
Ne conservez pas la solution non utilisée.
prescrizione/consegna/cura |
elenco I
| farmaci riservati all'uso dell'ospedale e per l'uso in situazioni di emergenza secondo l'articolo R.5121-96 del Codice di sanità pubblica. |
| AMM | 34009557184 Rev 06.09.2024) 10 mg. |
| 3400955852933 (1987, RCP Rev 06.09.2024) 20 mg. |
| 3400955853015 (1987, RCP Rev 06.09.2024) 50 mg. |