Gli attacchi di epilessia incidono fortemente sulla qualità della vita dei pazienti e quella dei loro caregiver.
Epidyolex 100 mg/ml di soluzione orale può ora essere emessa in farmacia, sul neuropediatra di prescrizione iniziale dell'ospedale.
Epidyolex è la prima specialità basata sul cannabidiolo commercializzato in Italia. Prima di questo marketing "ufficiale", Epidyolex era disponibile in autorizzazione temporanea all'utilizzo (dal 2018), quindi in Compationato Access Authorization (AAC) che si è conclusa il 21 dicembre 2022.
Epidiolex è indicato in neurologia, nel trattamento adiuvante delle crisi dell'epilessia negli adulti e nei bambini e oltre: | Clobazam, nel trattamento adiuvante degli attacchi di epilessia associati alla sindrome di Lennox-Gastaut (SLG) o alla sindrome di Dravet (SD);
- en association au clobazam, dans le traitement adjuvant des crises d'épilepsie associées au syndrome de Lennox-Gastaut (SLG) ou au syndrome de Dravet (SD) ;
- nel trattamento adiuvante degli attacchi di epilessia associati alla sclerosi tubereusa di Bourneville (STB).
Il dosaggio di Epidiolex è:
- in iniziazione, di 2,5 mg/kg 2 volte al giorno (5 mg/kg/giorno) per una settimana; | Mg/kg 2 volte al giorno (10 mg/kg/giorno), corrispondente alla dose di mantenimento all'interno della struttura di un SLG o SD.
- puis de 5 mg/kg 2 fois par jour (10 mg/kg/jour), correspondant à la dose d'entretien dans le cadre d'un SLG ou SD.
L'aumento della dose deve essere effettuato con livelli di 2,5 mg/kg 2 volte al giorno, fino a una dose massima di:
- 10 mg/kg 2 volte al giorno (20 mg/kg/giorno) e SD;
- 12,5 mg/kg 2 volte al giorno (25 mg/kg/giorno) nell'indicazione STB.
La cessazione del trattamento deve essere eseguita gradualmente, nelle fasi.
La funzione epatica (transaminasi, bilirubina) deve essere attentamente monitorata durante il trattamento, a causa del rischio di coinvolgimento epatocellulare associato al cannabidiolo.
D'un point de vue pratique, EPIDYOLEX se présente en solution buvable prête à l'emploi, administrée avec une seringue pour administration orale. L'adaptateur doit être utilisé pour prélever la solution buvable.
sono fornite due siringhe, per scegliere in base al dosaggio prescritto:
- = dose di 100 mg o meno ((1 ml o meno): utilizzare la siringa di 1 ml;
- dose maggiore di 100 mg (più di 1 ml): utilizzare la siringa più grande di 5 ml.
Pour éviter des erreurs médicamenteuses, il est recommandé d'exprimer la dose à administrer en mL sur l'ordonnance, étant donné que le dispositif d'administration est gradué en mL.
EPIDYOLEX peut être pris avec ou sans aliments, mais l'administration doit se faire dans les mêmes conditions chaque jour.
L'administration par sonde nasogastrique ou gastrostomie peut être envisagée si nécessaire.
EPIDYOLEX est agréé aux collectivités et remboursable à 65 % (boîte de 1 flacon = 1 066,74 euros). Dans le cadre des crises d'épilepsie associées à une sclérose tubéreuse de Bourneville, le périmètre de remboursement est restreint aux patients présentant une épilepsie pharmacorésistante.
La spécialité à base de cannabidiol EPIDYOLEX 100 mg/mL solution buvable est désormais disponible en pharmacie d'officine. Jusqu'à présent, elle était mise à disposition dans le cadre d'une autorisation temporaire d'utilisation ATU (dès juin 2018), puis d'une autorisation d'accès compassionnel AAC qui a pris fin le 21 décembre 2022.
EPIDYOLEX est un médicament de neurologie, indiqué chez l'adulte et l'enfant de 2 ans et plus (cf. VIDAL Recos « Épilepsie de l'adulte » et « Épilepsie de l'enfant »):
- in associazione a Clobazam, nel trattamento adiuvante degli attacchi di epilessia associati a Sindrome di Lennox-Gastaut (SLG) o sindrome di Dravet (SDB). Epilesia Crissia.
- dans le traitement adjuvant des crises d'épilepsie associées à une sclérose tubéreuse de Bourneville (STB).
Évaluation médico-économique : d'un SMR important à insuffisant selon l'indication
EPIDYOLEX a fait l'objet de deux avis successifs par la Commission de la transparence (CT) :
- un premier avis en 2020 portant sur l'indication en traitement des crises d'épilepsie associées au syndrome de Lennox/Gastaut et au syndrome de Dravet [1] ;
- un second avis en 2021 portant sur l'indication en traitement des crises d’épilepsie associées à une sclérose tubéreuse de Bourneville [2].
Un SMR important et une ASMR mineure dans le cadre des syndromes de Lennox-Gastaut et de Dravet
Selon son avis du 13 mai 2020, la CT a attribué à EPIDYOLEX dans le traitement des crises d'épilepsie associées au syndrome de Lennox-Gastaut ou au syndrome de Dravet :
- un service médical rendu (SMR) important dans l'indication de l'autorisation de mise sur le marché (AMM) ;
- une amélioration du SMR mineure (ASMR IV).
La CT s'est notamment appuyée sur les données issues de quatre études cliniques de phase III, de schémas similaires, randomisées en double aveugle ayant évalué la supériorité du cannabidiol contro Placebo, per adiuvante di un trattamento convenzionale (principalmente Clobazam):
- Due studi sul trattamento delle crisi associate alla sindrome di Dravet nei bambini: GWPCARE1 -B (corrispondente alla parte B dello studio - Parte A corrispondente a uno studio di ricerca sulla dose) [ 3] e gwpcare2 (non pubblicati al momento della valutazione da parte del CT);
- Due studi sul trattamento delle crisi associate alla sindrome di Lennox-Gastaut in bambini e adulti: GWPCARE3 [ 4] e gwpcare4 [ 5]. | D'Epidyolex è stato dimostrato sui seguenti criteri di giudizio:
Dans ces études, la supériorité d'EPIDYOLEX a été démontrée sur les critères de jugement principal suivants :
- Per la sindrome di Dravet: variazione della frequenza totale delle crisi a breve termine in 14 settimane, la differenza mediana osservata è stata del -22,8% IC95% [-41,1; -5.4] (p = 0,0123) contro Placebo (studio GWPCARE1-B) e la percentuale di riduzione del 25,7% di CI95% [2,9; 43,2] (P = 0,0299) al 29,8% IC95% [8,4; 46.2] (p = 0,0095) [studio GWPCARE2];
- Per la sindrome di Lennox-Gastaut: variazione della frequenza totale delle crisi con caduta a breve termine per 14 settimane rispetto all'inclusione, la differenza mediana osservata, contro Placebo è stato -17,2% CI95% [-30,3; -4.1] (p = 0,0135) [GWPCARE4] a -21,6% CI95% [-34,8; -6,7] (p = 0,0047) [GWPCARE3].
la Commissione A "ha salutato la realizzazione di studi clinici comparativi della fase III in queste malattie rare e pediatriche".
Sclérose de Bourneville : un SMR favorable uniquement en présence de pharmacorésistance
l'opinione di 1 ER dicembre 2021 si concentrava sugli attacchi di epilessia associati a una sclerosi tubereusa di Bourneville (STB). Il CT ha attribuito un SMR favorevole all'epidiolex in un'indicazione limitata rispetto a quella dell'AMM:
- SMR moderato solo nei pazienti con epilessia farmacoreista;
- SMR insufficiente nei pazienti con epilessia non farmacoreista;
- no ASMR.
Il CT si basava sui dati di uno studio pivot che avevano combinato due studi clinici sulla fase III:
- The International Multicenter Study, GWPCare6 [ 6] in doppio cieco, randomizzato, controllato contro Placebo: avendo dimostrato la superiorità del cannabidiolo in termini di riduzione del numero di crisi associate alla STB durante il periodo di trattamento (16 settimane) rispetto all'inclusione con una percentuale di riduzione del 30,1% di CI95% [13,9%; 43,3%] (p = 0,0009) in pazienti con un numero mediano da 54 a 61 crisi al mese fino all'inclusione, in un contesto di elevata farmacoresistenza;
- lo studio di monitoraggio openziale GWPCARE6 -OLE aperto, estensione dello studio GWPCARE6 volto a valutare la tolleranza a lungo termine del cannabidiolo e avendo mostrato, dopo una durata mediana di 38 settimane [3 -130 settimane], effetti avversi (è) simile a quelli già identificati con cannabidiolo, per conoscere principalmente: (44,7%), epiletti (epiletti (130 settimane], effetti avversi (sono) simili a quelli che sono già identificati con cannabidiolo, per conoscere principalmente: (44,7%), epiletti (epiletti. in appetito (23,1%), pyrexia (21,1%) e vomito (19,6%).
da notare che è associato al coinvolgimento epatico sono stati riportati nel gruppo Cannabidiol e non nei gruppi di placebo. Si trattava di aumenti di concentrazioni biologiche clinicamente anormali in ALAT (12,0 %), in ASAT (10,7 %) e GGT (16,0 %).
Raccomandazioni dostologiche
Epidyolex viene somministrato in 2 catture al giorno.
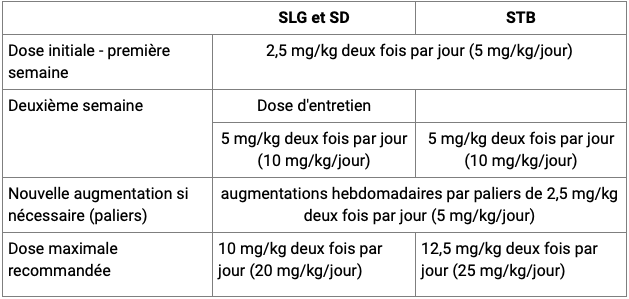
Il dosaggio del cannabidiolo consigliato è il seguente ( CF. Tabella): | : 2,5 mg/kg 2 volte al giorno (5 mg/kg/giorno) per una settimana;
- dose initiale : 2,5 mg/kg 2 fois par jour (5 mg/kg/jour) pendant une semaine ;
- Dopo una settimana, la dose deve essere aumentata alla dose di 5 mg/kg 2 volte al giorno (10 mg/kg/giorno), corrispondente a una dose di mantenimento come parte di un SLG o SD. | Individui, ogni dose può essere aumentata ogni settimana da livelli di 2,5 mg/kg 2 volte al giorno (5 mg/kg/giorno):
Selon la réponse clinique et la tolérance individuelles, chaque dose pourra être augmentée chaque semaine par paliers de 2,5 mg/kg 2 fois par jour (5 mg/kg/jour) :
- jusqu'à une dose maximale recommandée de 10 mg/kg 2 fois par jour (20 mg/kg/jour) dans le cadre d'un SLG ou d'un SD ;
- fino a una dose massima consigliata di 12,5 mg/kg 2 volte al giorno (25 mg/kg/giorno) come parte di una STB.
Un adattamento del dosaggio è necessario nei pazienti con insufficienza epatica da moderata a grave o ricevere altri farmaci (in particolare antiepilettici). | deve essere gradualmente ridotto.
Lors de l'arrêt du traitement, la dose doit être diminuée progressivement.
Tabella Riassumendo le raccomandazioni posologiche in funzione delle indicazioni (estratto dalla monografia vidale)
Surveillance des patients sous EPIDYOLEX : hépatique et psychiatrique
Il monitoraggio dei pazienti sotto l'epidiolex si concentra principalmente sulla funzione epatica, a causa del rischio di coinvolgimento epatocellulare associato al cannabidiolo.
En effet, le cannabidiol expose à des élévations dose-dépendantes des transaminases hépatiques (alanine aminotransférase [ALAT] et/ou aspartate aminotransférase [ASAT]) survenant généralement dans les 2 mois suivant l'instauration du traitement.
Cependant, des cas ont été observés jusqu'à 18 mois après l'instauration du traitement, en particulier chez les patients prenant un traitement associé par valproate.
Prima dell'introduzione del trattamento con cannabidiolo, dei tassi di transaminasi sierica (ALAT e ASAT) e della bilirubina totale devono essere controllati.
durante il trattamento, livelli sierici di transaminasi e mesi totali di bilirubina e 6 mesi dopo la creazione di trattamento con cannabidiolo e successivamente periodicamente o secondo l'indicazione clinica.
In caso di modifica della dose di cannabidiolo superiore a 10 mg/kg/die o qualsiasi cambiamento nei farmaci associati (modifica della dose o aggiunta di un altro trattamento) che probabilmente avrà un impatto sul fegato, questo programma di monitoraggio deve essere reipato.
I pazienti con aumento iniziale di ALAT o ASAT e pazienti che prendono valproato devono essere oggetto di monitoraggio intensificato, comprendente un dosaggio di transaminasi sieriche e tassi totali di bilirubina a 2 settimane, 1 mese, 2 mesi, 3 mesi e 6 mesi dopo l'introduzione del trattamento con cannabidiolo e regolarmente successivamente o in base all'indicazione clinica.
La sorveglianza durante il trattamento da cannabidiolo si riferisce anche a:
- la posizione di possibili segni di comportamenti e idee suicide;
- una perdita di peso o un calo dell'appetito o l'assenza di aumento di peso nei bambini.
Epidyolex in pratica
Epidyolex è confezionato in una scatola di 1 bottiglia di 100 ml di soluzione orale pronta all'uso, accompagnata da:
- 2 seringue di 1 ml 0,05 ml e un adattatore. Ogni livello di 0,05 ml corrisponde a 5 mg di cannabidiolo;
- 2 siringhe di 5 ml con graduazioni di 0,1 ml e un adattatore. Ogni livello di 0,1 ml corrisponde a 10 mg di cannabidiolo.
Per ciascuno di questi imballaggi, la seconda siringa corrisponde a una siringa di riserva nel caso in cui la prima sia danneggiata o persa.
Una volta aperta la bottiglia per la prima volta, la soluzione orale deve essere utilizzata entro 12 settimane.
= Selezione della siringa
La siringa che verrà usata dose prescritta:
- Se la dose calcolata è di 100 mg o meno (1 ml di soluzione o meno), è necessario utilizzare la siringa più piccola di 1 ml;
- Se la dose calcolata è maggiore di 100 mg (più di 1 ml di soluzione), è necessario utilizzare la siringa più grande di 5 ml. | Ti consente di collegare la siringa alla bottiglia, per prendere la soluzione orale.
L'adaptateur fourni permet de connecter la seringue au flacon, pour prélever la solution buvable.
Prescrive la dose in ML
La dose calcolata deve essere arrotondata al livello più vicino.
Per evitare errori di droga, la dose prescritta deve essere espressa in ML sulla prescrizione per essere coerente con la laurea (del sistema di somministrazione.
=
Nel settembre 2021, l'Alta autorità per la salute (ha) pubblicato un foglio relativo al rischio di errore di dose legata al sistema di amministrazione di Epidiolex (foglio elaborato nel quadro del sistema di aiuto decisionale indicizzato dalla medicina a cui si fa riferimento) [ 7] in cui raccomanda agli operatori sanitari:
- lors de la prescription : indiquer sur l'ordonnance la dose à administrer en mL ;
- durante la distribuzione: se la prescrizione è espressa in Mg, convertita in ML e indicando al paziente la siringa da utilizzare.
delle identiche condizioni amministrative ogni giorno
L'epidiolex può essere preso con o senza cibo, incluso nel caso di una dieta chetogenica (pasto ricco di grassi), rispettando le condizioni identiche di presa ogni giorno.
In caso di assunzione con il cibo, una composizione alimentare simile deve essere prevista, se possibile. Il cibo può aumentare i livelli di cannabidiolo.
Si consiglia la somministrazione orale; Le sonde nasogastriche e gastrostomiche possono essere utilizzate, se necessario, per una somministrazione enterale.
Identità amministrativa
elenco I [ 8]
=
Ospedale annuale di prescrizione iniziale
Prescrizione iniziale e rinnovo riservato agli specialisti in neurologia e neuropediatria
Monitoraggio speciale durante il trattamento
=
Bottiglia da 100 ml + 4 siringhe + 2 adattatori, CIP 34009 3018796 8
=
Rimborsabile al 65 % [ 9] ( CF. incorniciata) |.
Price pubblico TTC = 1.066,74 euro [
Prix public TTC = 1 066,74 euros [ 10]
=
Approvazione per le comunità [ 11] ( CF. incorniciata) |.
Laboratory Jazz Pharmaceuticals
Laboratoire Jazz Pharmaceuticals
|
[1] || 632 Avis de la Commission de la transparence - EPIDYOLEX/syndrome de Lennox-Gastaut ou syndrome de Dravet (ha, 13 maggio 2020)
[2]= Opinione della Commissione di trasparenza - Epidyolex/ Bourneville (ha, 1 ER dicembre 2021)
[3] Devinsky O, Cross JH, Laux L e al. Prova di cannabidiolo per convulsioni resistenti alla droga nella sindrome di Dravet. N Engl J Med., 2017; 376: 2011-2020
[4] Devinsky O, Patel AD, Cross JH e al. Effetto del cannabidiolo sulle convulsioni a goccia nella sindrome di Lennox-Gastaut. N Engl J Med., 2018; 378: 1888-1897
[5] Thiele EA, Marsh Ed, francese JA e Al. Cannabidiolo in pazienti con convulsioni associate alla sindrome di Lennox-Gastaut (GWPCARE4): uno studio di fase 3 randomizzato, doppio-lento, controllato con placebo. Lancet, 2018; 391: 1085-1096
[6] Thiele EA, Bebin EM, Bhathal H e al. .. JAMA Neurol., 2021; 78 (3): 285-292. Doi: 10.1001/jamalerol.2020.4607
[7] Avviso sul rischio di errore di dose collegato al dispositivo di somministrazione di Epidyolex 100 mg/ml Soluzione buvibile (ha, 9 settembre 2021)
[8] | 679 gennaio 2020 Exemping the Regulation of Narcotics and Ranking Classification nell'elenco I di sostanze velenose - EpidyolexArrêté du 21 janvier 2020 portant exonération à la réglementation des stupéfiants et portant classement sur la liste I des substances vénéneuses - EPIDYOLEX ( Journal ufficiale del 24 gennaio 2020 - Testo 11)
[9] Decreto del 14 dicembre 2022 Farmaceutica rimborsabile alle persone assicurate - Epidyolex ( Journal ufficiale del 16 dicembre 202 - Testo 36)
[10]= recensioni relative ai prezzi di una specialità farmaceutica - Epidyolex || ( ( Journal ufficiale del 16 dicembre 2022 - Testo 103)
[11] Decreto del 14 dicembre 2022 Modifica dell'elenco delle specialità farmaceutiche approvate per l'uso di comunità e vari servizi pubblici - Epidyolex (Journal officiel du 16 décembre 2022 - texte 37)

 10 minuti
10 minuti Aggiungi un commento
Aggiungi un commento

Commenti
Clicca qui per tornare alla reception.