Veuillez saisir au moins 3 caractères pour votre recherche.
Riepilogo
Connettiti per accedere a questo contenuto
= Expipient del solvente: polimero dl-lattide coglycolid, N-metilpirrolidone
CIP: 3400936690929
Modalités de conservation : Avant ouverture : 2° < t < 8° durant 24 mois (Conserver à l'abri de l'humidité, Conserver dans son emballage, Conserver au réfrigérateur)
forme e presentazioni | Iniettabile. |
Poudre et solvant pour solution injectable.
polvere (siringa B): siringa pre-riempita con polvere bianca bianca bianca.
Solvant (siringa A): siringa pre-riempita con una soluzione chiara e incolore al giallo pallido. | (Calibro 20).
Kit contenant 1 plateau thermoformé et 1 aiguille stérile (20 gauge).
L'altopiano contiene un sistema di siringa pre-collegato:
scatola di 1 kit +1 bustina essiccante.
Composizione |
Una siringa pre-riempita di polvere per soluzione di iniezione contiene 22,5 mg di acetato di leuproéline, corrispondente a 20,87 mg di leuproéline.
Solvant (seringue A) : poli (D, co-glicolide L-lattide) (25:75), N-metilpirrolidone.
polvere (siringa B): Excipient.
Indicazioni |
Eligard 22,5 mg è indicato per il trattamento del cancro della prostata ormonale-dipendente in uno stadio avanzato e in combinazione con la radioterapia nel trattamento del carcinoma della prostata situato ad alto rischio e dipendente dall'ormone locale. | Amministrazione
POSOLOGIE ET MODE D'ADMINISTRATION |
Connect per accedere a questo contenuto
Contraindicazioni |
Connect per accedere a questo contenuto
modi e precauzioni per l'uso |
Reconstitution correcte du médicament : Des cas d'erreur de manipulation pouvant se produire à n'importe quelle étape du processus de préparation et pouvant conduire à un manque d'efficacité ont été rapportés. Les instructions de reconstitution et d'administration doivent être strictement respectées (voir la rubrique eliminazione/manipolazione). In caso di un errore di manipolazione sospetto o comprovato, il paziente deve essere oggetto di un'adeguata sorveglianza (vedere la sezione Dosaggio e modalità di somministrazione).
Un trattamento per delezione androgenica può estendere l'intervallo Qt : Nei pazienti con storia o fattori di rischio per l'intervallo QT e nei pazienti che ricevono farmaci concomitanti che potrebbero estendere l'intervallo QT (vedere la sezione interazioni), i medici devono valutare il rapporto beneficio/rischio prendendo in considerazione il potenziale rischio di punte di spikes prima dell'inizio del trattamento con Eligard con Eligard .5 Mg.
malattie cardiovascolari: un aumento del rischio di morte improvvisa. Il cuore e l'ictus sono stati segnalati quando si utilizzano agonisti GNRH in alcuni pazienti. Il rischio sembra basso sulla base dei rapporti pubblicati e dovrà essere valutato attentamente in base ai fattori di rischio cardiovascolare dei pazienti con carcinoma della prostata quando si sceglie il trattamento. La comparsa di sintomi e segni evocativi delle malattie cardiovascolari deve essere monitorata nei pazienti trattati da un agonista GNRH e curati, in conformità con le raccomandazioni in vigore.
Elevazione di transizione dei livelli di testosterone: L'acetato di Leuproéline, come gli altri agonisti del GNRH, porta a un aumento di transizione delle fosfatasi sieriche di testosterone, diidrotestosterone e acido durante la prima settimana di trattamento. I pazienti possono avere un peggioramento dei sintomi o vedere nuovi sintomi come dolore osseo, neuropatia, ematuria, ostruzione ureterale o vescicale (vedere Sezione Effetti avversi). Questi sintomi di solito scompaiono nella ricerca del trattamento.
La somministrazione associata di un anti-androgeno appropriato deve essere prevista iniziando 3 giorni prima del trattamento con leuproéline e proseguire durante le prime due o tre settimane di trattamento. È stato osservato che questi metodi consentono di prevenire le conseguenze di un aumento iniziale del testosterone sierico.
Après castration chirurgicale, ELIGARD 22,5 mg n'entraîne pas de diminution supplémentaire de la testostéronémie chez les sujets masculins.
Densità ossea: Une diminution de la densité osseuse a été rapportée dans la littérature médicale chez les hommes ayant subi une orchidectomie ou ayant été traités par un agoniste de la GnRH (voir rubrique Effetti avversi).
Il trattamento anti-androgeno aumenta significativamente il rischio di fratture secondarie all'osteoporosi. C'è solo un numero limitato di dati su questo argomento. Fratture secondarie all'osteoporosi sono state osservate nel 5% dei pazienti dopo 22 mesi di trattamento farmacologico della privazione degli androgeni e nel 4% dei pazienti dopo 5-10 anni di trattamento. Il rischio di fratture di origine osteoporotica è generalmente superiore al rischio di fratture patologiche. Oltre a un deficit prolungato nel testosterone, un'età avanzata, il fumo e il consumo di bevande alcoliche, l'obesità e la mancanza di esercizio fisico possono anche promuovere lo sviluppo dell'osteoporosi.
= Apoplexy ipofisario: Lors de la surveillance après la commercialisation, de rares cas d'apoplexie pituitaire (un syndrome clinique secondaire à un infarctus de la glande pituitaire) ont été rapportés après l'administration d'agonistes de la GnRH, la majorité survenant dans les 2 semaines suivant la première administration, et certaines dans la première heure. Dans ces cas, l'apoplexie pituitaire s'est manifestée sous la forme d'une céphalée soudaine, de vomissements, de troubles de la vision, d'ophtalmoplégie, d'un état mental altéré, et parfois d'un collapsus cardiovasculaire. Une prise en charge médicale immédiate est requise.
Modifiche metaboliche: iperglicemia e un aumentato rischio della comparsa del diabete sono stati segnalati negli uomini che ricevono agonisti GNRH. È probabile che l'iperglicemia sia collegata alla comparsa del diabete del pasto o alla degradazione del controllo glicemico nei pazienti diabetici. La glicemia e/o il livello dell'emoglobina glicosilata (HbA1C) devono essere monitorati periodicamente nei pazienti che ricevono un agonista GNRH e quest'ultimo deve essere curato seguendo le pratiche in vigore per quanto riguarda il trattamento dell'iperglicemia o del diabete. Le modifiche metaboliche legate agli agonisti del GNRH possono anche includere la steatosi epatica.
Convulsioni: I lettori di convulsioni sono stati riportati dopo il marketing in pazienti trattati con acetato di leuproé con o senza storia di fattori predisponenti. Queste convulsioni devono essere curate secondo le attuali pratiche cliniche.
Hypertension intracrânienne idiopathique: casi di ipertensione intracranica idiopatica (meningite sierosa) sono stati riportati in pazienti che ricevono leuproéline. I pazienti dovrebbero essere avvertiti della possibilità di segni e sintomi di ipertensione intracranica idiopatica, in particolare mal di testa gravi o ricorrenti, disturbi visivi e acufene. In presenza di ipertensione intracranica idiopatica, deve essere prevista l'interruzione del trattamento con leuproéline.
Reazioni indesiderate della pelle grave: di gravi reazioni cutanee indesiderate (cicatrice), inclusa la sindrome di Stevens-Johnson (SSJ) e la necrolisi epidermica tossica (Sindrome da rete o Lyell), che possono avviare prognosi vitali o essere fatali, sono stati riportati in associazione con leoproé. Al momento della prescrizione, i pazienti devono essere informati di segni e sintomi e attentamente monitorati in caso di gravi reazioni cutanee. In caso di comparsa di segni e sintomi evocativi di queste reazioni, il trattamento con leuproéline deve essere fermato immediatamente e un altro trattamento deve essere previsto (se applicabile).
Autres événements : dei casi di ostruzione ureterale e compressione midollare probabilmente causano paralisi con o senza complicanze fatali degli agonisti del GNRH. La comparsa di una compressione del midollo spinale o di insufficienza renale richiede la creazione di un trattamento standard di queste complicanze.
I pazienti con metastasi vertebrali e/o cerebrali, nonché i pazienti con un ostruzione dei tratti urinari dovranno essere monitorati da vicino durante le prime settimane di trattamento.
interazioni |
Connettiti per accedere a questo contenuto
Fertilità/Gravidanza/Affetto al seno |
ORDICABLE perché Eligard 22,5 mg è controindicato nelle donne. | D'Eligard 22,5 mg sulla capacità di guidare i veicoli e di usare le macchine non sono state studiate.
CONDUITE et UTILISATION DE MACHINES |
Les effets d'ELIGARD 22,5 mg sur l'aptitude à conduire des véhicules et à utiliser des machines n'ont pas été étudiés.
Fatica, vertigini e disturbi della visione essendo possibili effetti collaterali del trattamento o la conseguenza della malattia sottostante, la capacità di guidare i veicoli e usare le macchine può essere modificata. | Indesiderato
EFFETS INDÉSIRABLES |
Connect per accedere a questo contenuto
Overdosage |
L'uso abusivo e il sovradosaggio volontario con Eligard 22,5 mg sono improbabili. Non è stato riportato alcun caso di occupazione abusiva o sovradosaggio con la pratica clinica con l'acetato di Leuproéline, ma se si è verificata un'esposizione eccessiva, si raccomandano il monitoraggio dei pazienti e la somministrazione di un trattamento sintomatico adiuvante.
Farmacodinamica |
Connettiti per accedere a questo contenuto
Pharmacokinetics |
Connettiti per accedere a questo contenuto
Preclinic Security |
Studi pre-clinici con acetato di leuproé hanno mostrato effetti sul sistema di riproduzione dei due sessi, effetti previsti del noto profilo farmacologico. Questi effetti si sono rivelati reversibili dopo aver interrotto il trattamento e un periodo di rigenerazione appropriato. L'acetato di Leuproéline non ha rivelato un'attività teratogena. L'embritossicità/letalità è stata osservata nei conigli, legati agli effetti farmacologici dell'acetato di leoproéline sul sistema riproduttivo.
di studi di cancerogenicità sono stati condotti nei ratti e nel topo per 24 mesi. Nei ratti, è stato osservato un aumento dose-dipendente degli apoplessie ipofisaria dopo la somministrazione sottocutanea a dosi da 0,6 a 4 mg/kg/giorno. Non è stato osservato alcun effetto di questo tipo nei topi.
L'acetato di leuproéline e la formulazione di 1 mese eligard 7,5 mg non si sono rivelati mutageni durante i test effettuati in vitro e in vivo.
incompatibilità |
Il leuproéline contenuto nella siringa B deve essere miscelato solo con il solvente della siringa A e non deve essere miscelato con altri farmaci.
Conservazione degli ufficiali |
prima della ricostruzione:
2 anni.
A volte in cui il prodotto è stato rimosso dal frigorifero, può essere mantenuto nella confezione originale a temperatura ambiente (non superiore a 25 ° C) per il massimo di 4 settimane.
Dopo la prima apertura dell'altopiano, la polvere e il solvente per ricostruire il farmaco e somministrarlo al paziente.
una volta ricostituiti : Amministrare immediatamente il prodotto, la viscosità della soluzione aumenta nel tempo.
Precauzioni in particolare conservazione |
da mantenere in frigorifero (tra 2 ° C e 8 ° C). umidità.
A conserver dans l'emballage extérieur d'origine, à l'abri de l'humidité.
Questo prodotto deve essere a temperatura ambiente prima dell'iniezione. Eliminalo dal frigorifero per circa 30 minuti prima dell'uso. Una volta fuori dal frigorifero, il prodotto può essere mantenuto nella sua confezione originale a temperatura ambiente (non superiore a 25 ° C) per il massimo di 4 settimane.
Precauzioni speciali per l'eliminazione e la manipolazione |
Lasciare il prodotto per riscaldarsi a temperatura ambiente quando lo lascia dal frigorifero circa 30 minuti prima dell'uso. | L'iniezione, quindi la preparazione del prodotto, seguendo le istruzioni di seguito. In caso di preparazione inadeguata del prodotto, quest'ultimo non deve essere somministrato, poiché può verificarsi una mancanza di efficienza clinica a causa di una ricostruzione errata del prodotto.
Merci de préparer en premier le patient pour l'injection, puis la préparation du produit, en suivant les instructions ci-dessous. En cas de préparation inadéquate du produit, ce dernier ne doit pas être administré, puisqu'un manque d'efficacité clinique peut survenir du fait d'une reconstitution incorrecte du produit.
Passaggio 1:
Su una superficie di lavoro pulita, apri il vassoio rimuovendo il foglio di alluminio dall'angolo per rimuovere il contenuto. Scartare la borsa essiccante.
Rimuovere il sistema di siringa pre-collegato (Figura 1.1) del vassoio. Apri l'imballaggio dell'ago sicuro (Figura 1.2) togliendo la scheda della carta.
Nota: la siringa A e la siringa B non devono ancora essere allineate.

Passaggio 2:
Prendi il pulsante di bloccaggio con il connettore con il dito e il pollice e premere (Figura 2) fino a sentire uno scatto. Le due siringhe saranno quindi allineate. Non è necessario un particolare orientamento del sistema di siringa per attivare il connettore. Non piegare il sistema di siringa (questo può causare perdite perché è possibile svitare parzialmente le siringhe).

Passaggio 3:
tenendo le siringhe in posizione orizzontale, trasferire il contenuto liquido della siringa A alla siringa B che contiene la polvere di acetato di Leuproéline.
Mélanger soigneusement le produit pendant 60 cycles en poussant doucement le contenu des deux seringues d'avant en arrière entre les deux seringues (un cycle correspond à une poussée du piston pour la seringue A et une poussée du piston pour la seringue B) en position horizontale, pour obtenir une solution homogène et visqueuse (Figure 3). Ne pas plier le système de seringues (cela peut provoquer des fuites car vous risquez de dévisser partiellement les seringues).
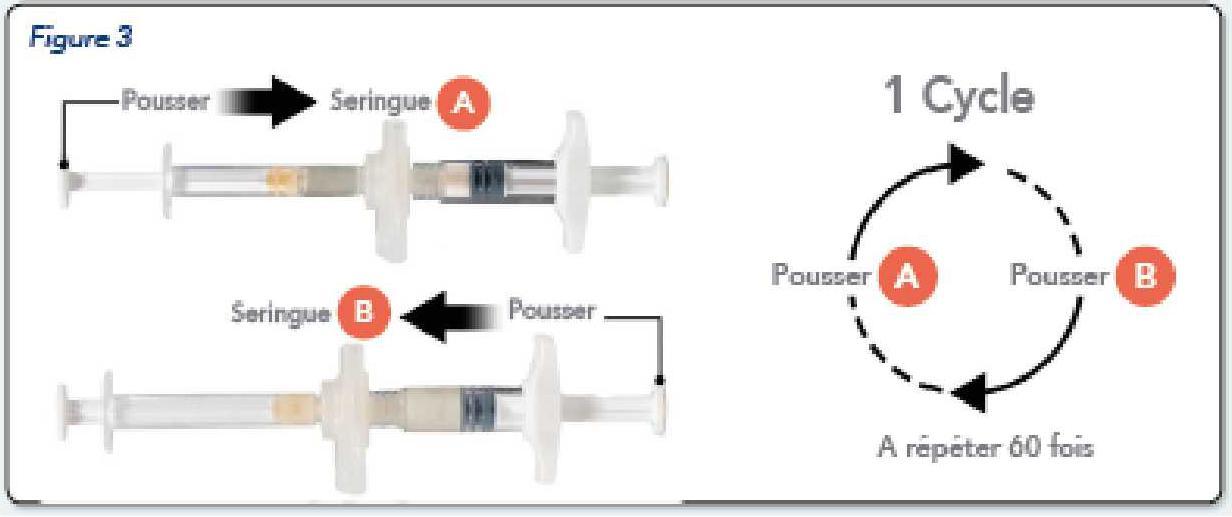
perfettamente miscelato, il prodotto apparirà viscoso con una gamma di colori che vanno dal giallo incolore, bianco, pallido (che include tutte le sfumature di bianco con giallo pallido). | Immediatamente, il prodotto diventa sempre più viscoso nel tempo. Non mettere il prodotto misto in frigorifero.
Important : Après avoir procédé au mélange, passer à l'étape suivante immédiatement, le produit devenant de plus en plus visqueux avec le temps. Ne pas mettre au réfrigérateur le produit mélangé.
Si noti che il prodotto deve essere miscelato come descritto; Salvarlo non mescolerà il prodotto correttamente.
Passaggio 4:
Après le mélange, tenir les seringues en position verticale, la seringue B étant en bas. Les seringues doivent rester bien assemblées. Transférer tout le produit mélangé dans la seringue B (la seringue large) en poussant le piston de la seringue A et en tirant doucement le piston de la seringue B en même temps (Figure 4).

Passaggio 5:
garantendo che il pistone della siringa A sia completamente bloccato, tieni il connettore e svita la siringa. La siringa A rimarrà collegata al connettore (Figura 5).
Assicurarsi che il prodotto non fugga perché altrimenti l'ago non verrà corretto correttamente.
Nota: possono rimanere piccole bolle d'aria o una grande bolla d'aria nella preparazione. Questo non è imbarazzante.
Durante questa fase, per favore non provare a eliminare le bolle d'aria della siringa B a causa del prodotto potrebbe essere perso!

Passaggio 6:
non serrare troppo perché questo può rompere la base dell'ago, causando una perdita del prodotto durante l'iniezione. Il dispositivo di sicurezza può anche essere danneggiato se l'ago è avvitato con troppa resistenza.
Se la base delle crepe dell'ago, sembra danneggiata o ha la minima perdita, il prodotto non dovrebbe essere utilizzato. L'ago danneggiato non deve essere sostituito/sostituito e il prodotto non deve essere iniettato. L'intero prodotto deve essere eliminato in modo sicuro.
Se la base dell'ago è danneggiata, un nuovo prodotto deve essere utilizzato per sostituire.

Passaggio 7:
Prepara il dispositivo di sicurezza dell'ago e rimuovere il tappo protettivo dell'ago solo prima della somministrazione del prodotto (Figura 7). | Non rispettare il dispositivo di sicurezza dell'ago prima dell'amministrazione.
Important : N'enclenchez pas le dispositif de sécurité de l'aiguille avant l'administration.
Se la punta dell'ago sembra danneggiata o ha una perdita, il prodotto non deve essere utilizzato. L'ago danneggiato non deve essere sostituito e il prodotto non deve essere iniettato. In questo caso, usa un'altra scatola di Eligard.

Passaggio 8:
prima dell'amministrazione, per eliminare il Big bolle oirteose della siringa B. Amministrare il prodotto mediante rotta cutanea mantenendo il dispositivo di sicurezza escluso dall'ago. | Amministrazione:
Procédure d'administration :
|
|
Passaggio 9:
Dopo l'iniezione, bloccare il dispositivo di sicurezza seguendo le istruzioni elencate di seguito:
1. Chiusura su una superficie piana
Premi il dispositivo di sicurezza, leva nella parte inferiore, su una superficie piana (Figura 9A) per coprire l'ago e bloccare il dispositivo di sicurezza.
Un « Clic » confirme, de façon sonore et tactile, que le dispositif est verrouillé. En position verrouillée, la pointe de l'aiguille est complètement recouverte.
2. Chiusura con il pollice
Posizionare il pollice sul dispositivo di sicurezza (Figura 9b), coprire la punta dell'ago e bloccare il dispositivo di sicurezza.

A "Click" conferma, in un suono e tocco -up, che il dispositivo è bloccato. In posizione bloccata, il punto dell'ago è completamente coperto.
Una volta bloccato il dispositivo di sicurezza, gettare immediatamente l'ago e la siringa in una cestino appropriato.
prescrizione/consegna/gestione |
| AMM |
|
| Prezzo: |
|